交联透明质酸(cross-linked hyaluronic acid,CLHA)是临床常用的短效软组织填充剂,常用交联剂为1,4-丁二醇二缩水甘油醚[1-2]。脂肪移植所用的颗粒脂肪也是临床常见的软组织填充材料,其具有组织相容性佳和效果持久的优点[3-4]。CLHA 的代谢时间较短,常为6个月~2 年[2],而颗粒脂肪的维持时间则较为持久[5]。临床上常有患者在局部CLHA 未代谢或可能未代谢时寻求施行颗粒脂肪移植,但组织内留存的CLHA 对移植脂肪的影响尚存争议[6]。为此,本研究拟将定制CLHA 和人脂肪组织混合移植于裸鼠皮下,通过大体观察、体积测量、组织学评估和免疫组织化学染色法检测脂周蛋白-1(Perilipin-1)、CD31 和血管内皮生长因子(vascular endothelial growth factor,VEGF)等方法,探讨CLHA 对颗粒脂肪成活的影响,为临床提供动物实验依据。
1 材料与方法
1.1 实验动物
8 周龄SPF 级雌性BALB/c 裸鼠72 只,健康状况良好,体重22~24 g,购于北京华阜康生物科技股份有限公司,实验动物生产许可证号:SCXK(京)2019-0008;使用许可证号:SYXK(京)2020-0018;动物合格证号:110322231101961515。实验动物饲养于中国医学科学院整形外科医院SPF 级动物房。本研究经中国医学科学院整形外科医院医学伦理委员会审查批准,审查编号:(2022)注册第(58)号。
1.2 仪器与试剂
定制CLHA 由生物可降解新材料北京市工程实验室制备,设计代谢时间为12 周。免疫组织化学染色所用一抗Anti-Perilipin-1(Ab3526)、Anti-CD31(Ab 28364)、Anti-VEGFA(Ab46154)及二抗Goat Anti-Rabbit IgG H&L(Ab205718)均购于英国Abcam 公司;免疫组织化学染色试剂盒(SV0004)购于武汉博士德生物工程有限公司。
1.3 颗粒脂肪的制备
人颗粒脂肪来自中国医学科学院整形外科医院行腹部吸脂术的1 名女性(体重指数为24 kg/m2),术前已签署知情同意书。具体吸脂操作及吸脂物处理方法:采用直径2.5 cm、侧孔2 mm×4 mm 吸脂针,在负压40 kPa 下自腹部获取脂肪抽吸物150 ml。采用棉垫浓缩法纯化储脂罐内脂肪抽吸物静置10 min 后,吸去下层液体和沉淀,再倒入与脂肪抽吸物等体积的4 ℃生理盐水轻柔洗涤约1 min,再次吸去下层液体和沉淀,重复3次。清洗过程中使用吸脂针搅动抽吸物以去除粗大纤维。清洗后的抽吸物置于下衬无菌棉垫的4 层纱布上,静置15 min 以去除抽吸物中的油脂和液体,所得即为制备完成的脂肪移植物;将5 ml制得的脂肪移植物备用。所有操作均于无菌条件下进行。制备完成后,即刻开始后续动物实验。
1.4 实验分组及处理
72 只裸鼠分为两部分,一部分(24 只)用于验证定制CLHA 的完全代谢时间,同时采集各时间点的剩余定制CLHA 体积;另一部分(48 只)用于研究定制CLHA 对颗粒脂肪存活的影响。
1.4.1 定制CLHA 代谢速率确定 使用随机数字表法将24 只裸鼠分为A、B、C、D 组,每组6 只。所有裸鼠均于异氟烷麻醉后,在无菌条件下使用1 ml 螺口注射器、18 G 钝针,以边退边注射的方式,多隧道、多点、均匀地将0.3 ml 定制CLHA 平铺于小鼠背部正中皮下。随后,以二氧化碳法,于操作完毕时处死正常裸鼠,术后1 周时处死A 组裸鼠,术后2 周时处死B 组裸鼠,术后4 周时处死C 组裸鼠,术后12 周时处死D 组裸鼠。裸鼠处死后,即以开放手术取出背部注射区剩余的定制CLHA,另取裸鼠背部未注射区的正常皮肤和皮下组织作为阴性对照,进行后续指标观察及检测。
1.4.2 定制CLHA 对颗粒脂肪的存活影响 使用随机数字表法将48 只裸鼠分为实验组与对照组,每组24只。对于实验组,按照“1.4.1”部分处理方式在每只小鼠背部正中皮下移植预先混匀的0.3 ml 定制CLHA 与0.3 ml 人颗粒脂肪;对照组则以同样方式在每只小鼠背部正中皮下移植0.3 ml 人颗粒脂肪。于术后第1、2、4、12 周,分别以二氧化碳法处死两组各6 只小鼠;处死小鼠后,取出其背部的移植物,行后续指标观察及检测。
1.5 观察指标
1.5.1 大体观察及体积保留率测定 取材后,以肉眼观察标本颜色、质地及血管生成等大体情况,并作记录。随后,同既往文献[7]所描述的排水法,将标本移入一次性无菌注射器内,并将活塞固定于2 ml 处。再取另一注射器吸取2 ml 无菌注射用水后置于微量电子天平称取重量(m1);将无菌注射用水注入装有标本的注射器内,将预先固定的2 ml 完全填满,操作尽量轻缓以避免气泡生成,再次称取仅装有无菌注射用水的注射器重量(m2)。对于“1.4.1”部分采用下述公式计算定制CLHA 的剩余体积:定制CLHA 剩余体积(ml)=[m1(g)-m2(g)]×1 g/ml;对于“1.4.2”部分采用下述公式计算标本的体积保留率:脂肪组织体积保留率(%)=[移植物体积(ml)-剩余定制CLHA 体积(ml)]/0.3 ml×100%。
1.5.2 HE 染色 对于“1.4.1”部分,将包含移植区及其上覆皮肤的组织块及正常皮肤皮下组织的组织块行常规石蜡包埋、切片、HE 染色后观察CLHA 代谢情况。对于“1.4.2”部分,则将移植物常规石蜡包埋、切片、HE染色后,每个标本在100 倍光学显微镜下随机选取10个视野观察组织和脂肪细胞形态结构,并由2 名病理科执业医师自5 个组织学维度(脂肪细胞完整性、坏死区域、油囊/空泡、纤维化区域、炎症细胞浸润)分别评估各视野下对应指标项的存在情况,行组织学评分(不存在为0 分,少量存在为1 分,少量至中等量存在为2 分,中等量存在为3 分,中等量至大量存在为4分,遍视野为5 分)。
1.5.3 免疫组织化学染色 采用SP 法行常规石蜡切片免疫组织化学染色。一抗使用Anti-Perilipin-1(1∶200)、Anti-CD31(1∶100)、Anti-VEGFA(1∶200),二抗使用Goat Anti-Rabbit IgG H&L(HRP)(1∶2 000)。使用Image J软件测定单位面积下Perilipin-1(+)活脂肪细胞占比、CD31(+)血管数量和VEGF 光密度值,并依下述公式计算有效体积保持率:有效体积保持率(%)=Perilipin-1(+)活脂肪细胞占比(%)×体积保留率(%)。
1.6 统计学方法
采用SPSS 26.0 和GraphPad Prism 9 统计学软件进行数据分析和绘图。符合正态分布的计量资料用均数±标准差(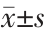 )表示,比较采用t 检验;不符合正态分布或非连续型计量资料采用中位数(M)和四分位数(P25,P75)表示,比较采用Mann-Whitney U 检验。以P<0.05 为差异有统计学意义。
)表示,比较采用t 检验;不符合正态分布或非连续型计量资料采用中位数(M)和四分位数(P25,P75)表示,比较采用Mann-Whitney U 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 定制CLHA 的代谢结果
大体观方面,随着时间推移,移植后定制CLHA的肉眼观和实测体积均逐渐减小,D 组不再可见定制CLHA。HE 染色结果显示,A 组可见大量成片淡蓝紫色的定制CLHA 分布在组织间隙中;B 组可见间质出现纤维化和炎症细胞浸润,定制CLHA 呈分散分布;C组可见组织间质疏松、增宽,间质纤维化加剧,炎症细胞浸润增加,定制CLHA 面积有所减少;D 组视野中未见定制CLHA,注射部位皮下结构与正常皮下结构相似。见图1。
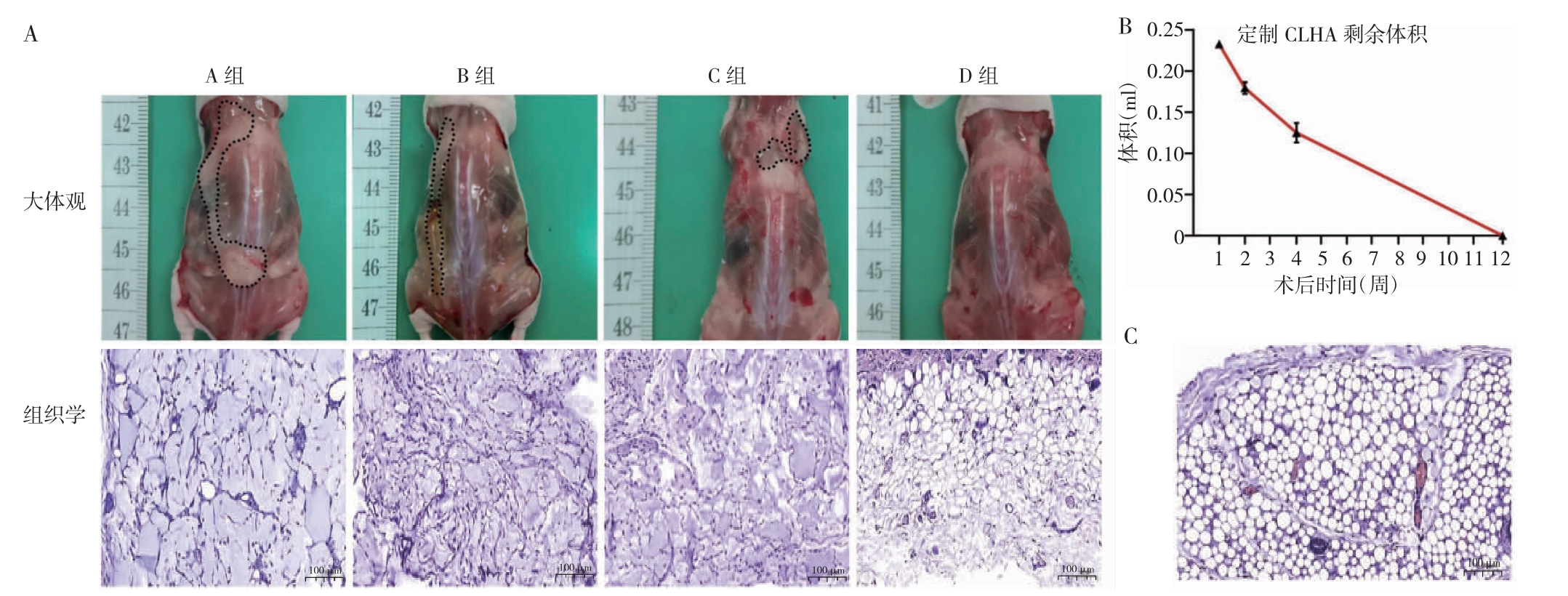
图1 定制CLHA 的代谢结果
A:四组剩余定制CLHA(点线圈出部分)大体观及HE 染色图像;B:不同时间点定制CLHA 剩余体积;C:正常裸鼠皮下组织HE 染色图像。CLHA:交联透明质酸。
2.2 定制CLHA 对颗粒脂肪存活的影响
2.2.1 两组各时间点移植物大体观及体积保留率比较大体观方面,两组移植物大体呈淡黄色,表面光滑、包膜完整、质软,无明显坏死迹象。术后1、2 周,实验组移植物周边可见透明状CLHA,术后12 周不可见。两组移植物表面的新生血管在移植后早期均逐渐增多;实验组在术后4 周时新生血管最多,而术后12 周时则较前减少,对照组各时间点移植物整体新生血管分布较均匀。见图2。术后1、2、4、12 周,实验组体积保留率均低于对照组(P<0.05)。见表1。
表1 两组各时间点体积保留率比较(%,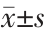 )
)
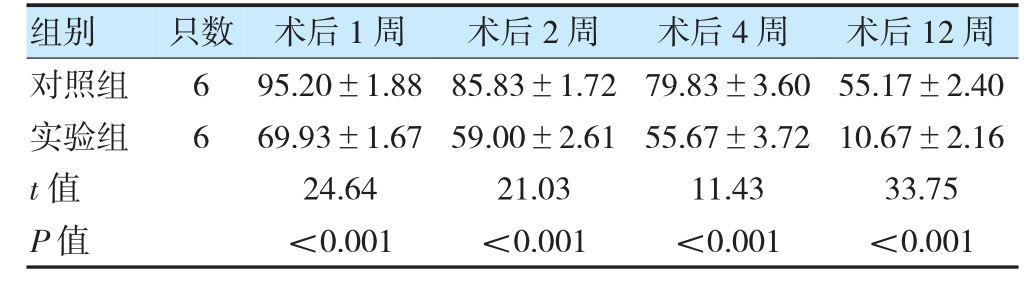

图2 两组移植物(点线圈出部分)在各时间点的大体观
2.2.2 两组各时间点HE 染色结果 实验组移植物脂肪细胞间可见较多炎症细胞浸润和细胞外基质沉积,新生血管则主要集中于移植物外周;对照组则以结构较完好的脂肪细胞为主,炎症细胞浸润和细胞外基质沉积则较少。见图3。
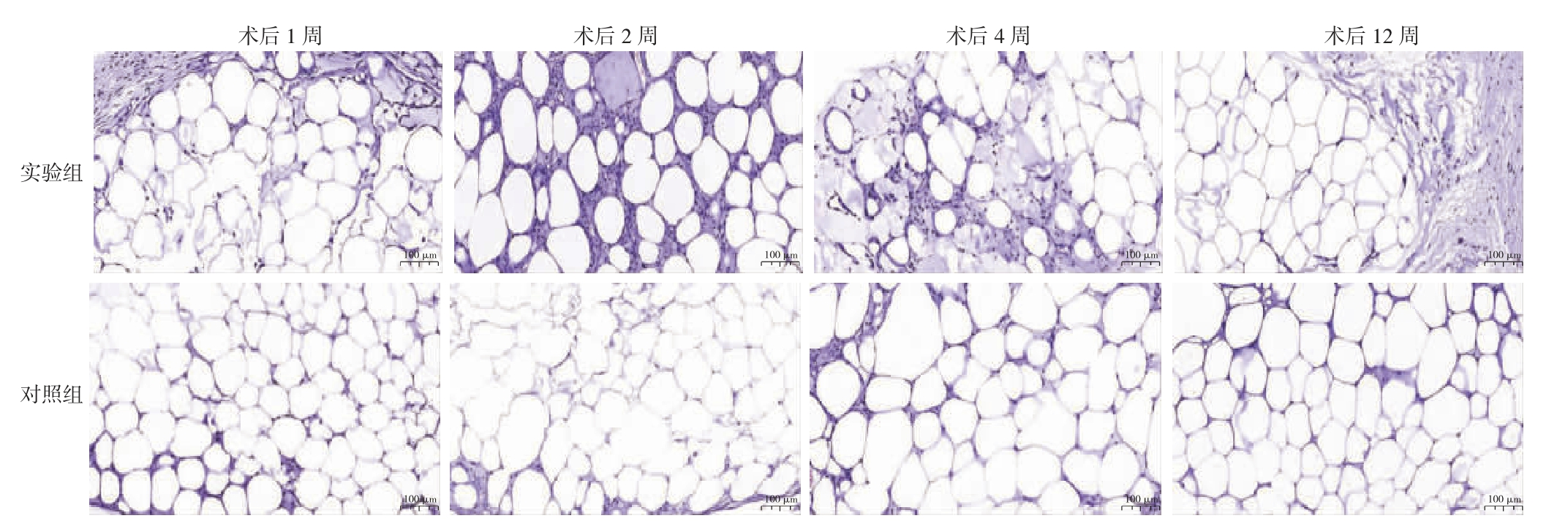
图3 两组移植物各时间点HE 染色
术后1、2、4、12 周,实验组脂肪细胞完整性评分低于对照组,纤维化区域和炎症细胞浸润评分高于对照组(P<0.05);术后1、4、12 周,实验组坏死区域评分高于对照组(P<0.05);术后2、4、12 周,实验组油囊/空泡评分低于对照组(P<0.05)。见表2。
表2 两组各时间点的组织学评分比较[M(P25,P75)]
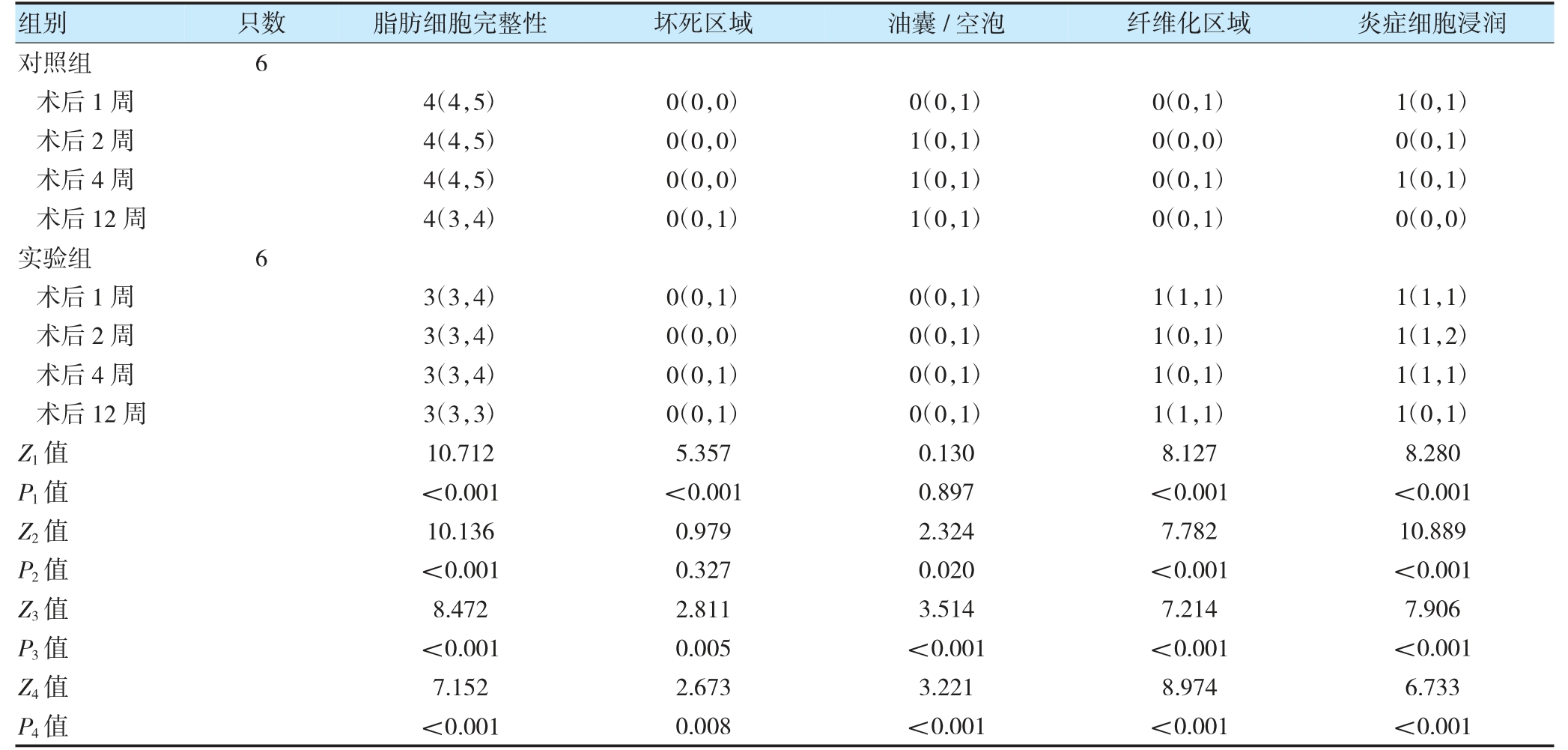
注Z1、P1 为两组术后1 周比较;Z2、P2 为两组术后2 周比较;Z3、P3 为两组术后4 周比较;Z4、P4 为两组术后12 周比较。
2.2.3 两组各时间点Perilipin-1 相关结果比较 Perilipin-1(+)活脂肪细胞具深棕色边缘。实验组的活脂肪细胞早期体积较小、外形欠规则,但术后2 周脂肪细胞体积明显增加、外形趋圆润;对照组的活脂肪细胞形态均一性在各时间点均欠佳,且没有明显的体积增加趋势。在术后1、2 周,实验组Perilipin-1(+)活脂肪细胞占比低于对照组(P<0.05);术后4、12 周,实验组Perilipin-1(+)活脂肪细胞占比高于对照组,差异有统计学意义(P<0.05)。见图4、表3。
表3 两组各时间点Perilipin-1(+)活脂肪细胞占比比较[%,M(P25,P75)]

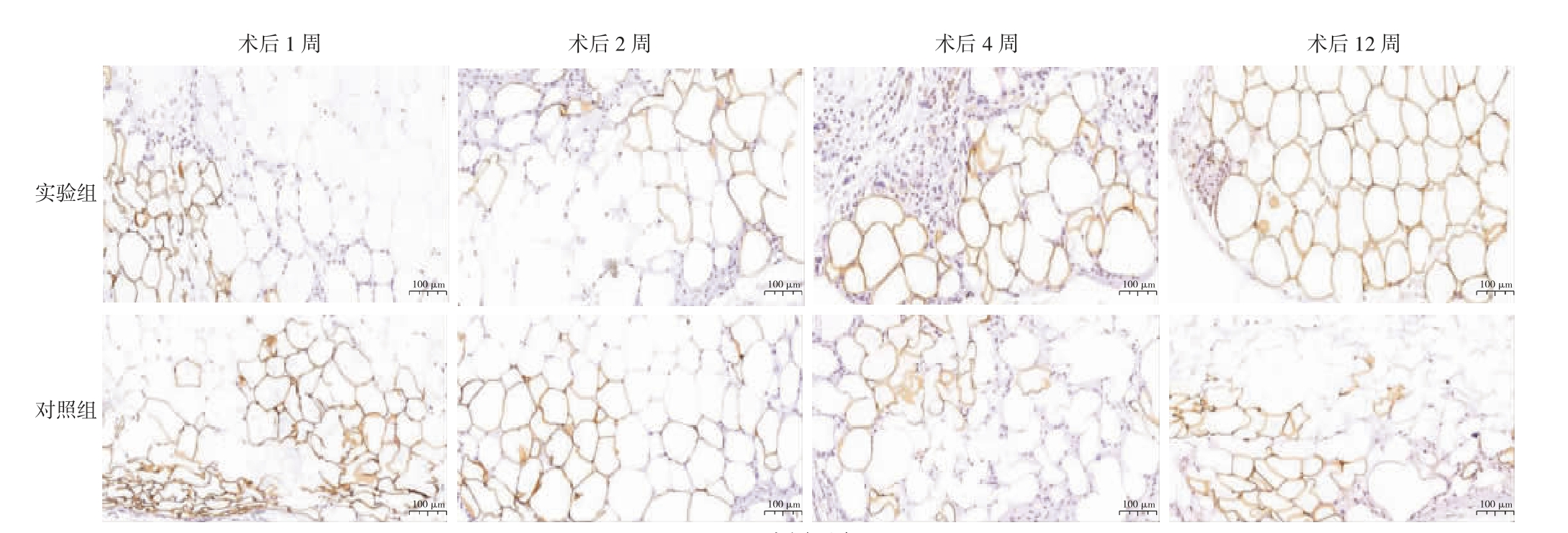
图4 两组移植物各时间点Perilipin-1 免疫组织化学染色
Perilipin-1:脂周蛋白-1。
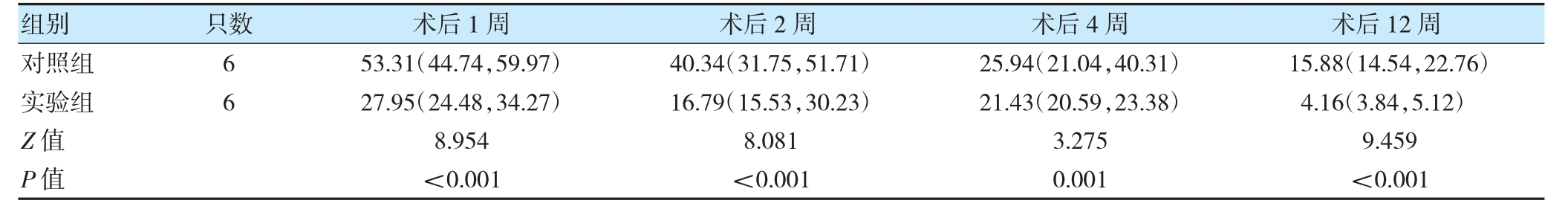
术后1、2、4、12 周,实验组有效体积保持率低于对照组(P<0.05)。见表4。
表4 两组各时间点有效体积保持率比较[%,M(P25,P75)]
2.2.4 两组各时间点CD31 相关结果比较 术后1、2周,实验组新生血管主要集中于移植物边缘,随时间推移逐渐长入内部;对照组血管分布则始终较为整体、均匀。术后1 周,实验组CD31(+)血管数量低于对照组(P<0.05);术后2、4、12 周,实验组CD31(+)血管数量高于对照组(P<0.05)。见图5、表5。
表5 两组各时间点CD31(+)血管数量比较(根, )
)
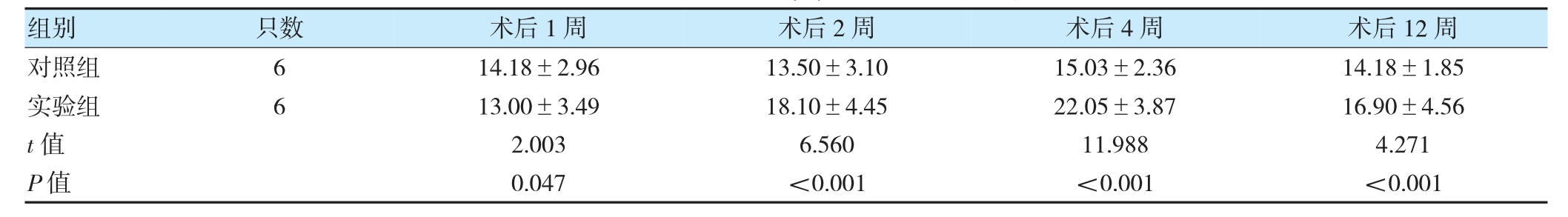
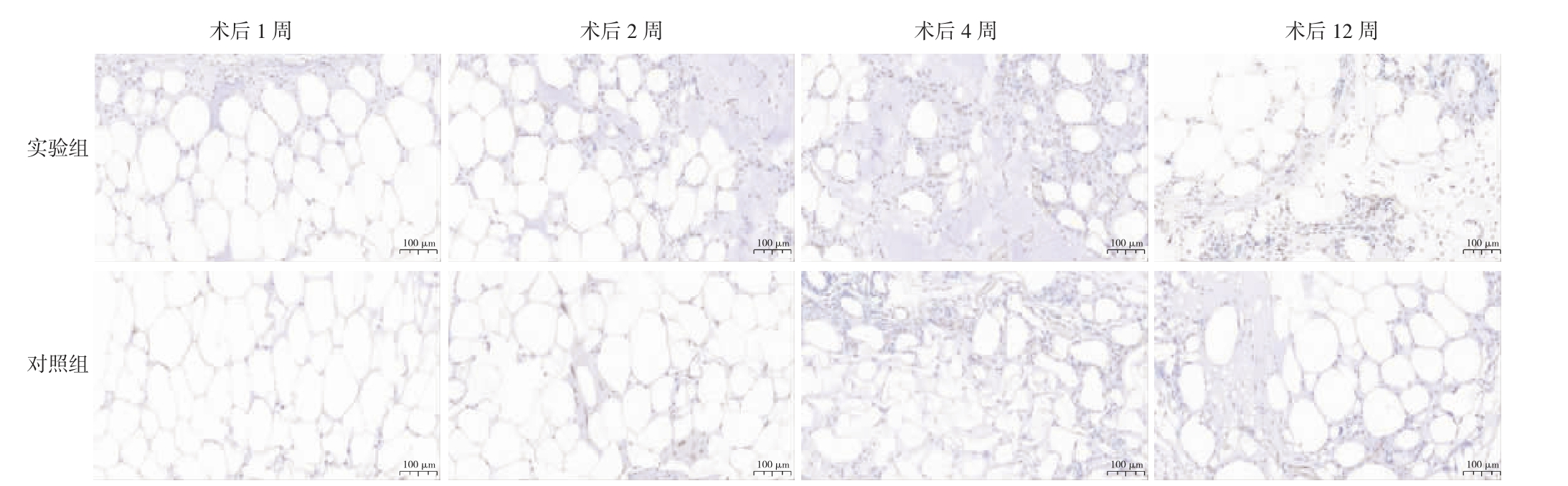
图5 两组移植物各时间点CD31 免疫组织化学染色
2.2.5 两组各时间点VEGF 相关结果比较 术后1、2、4、12 周,实验组VEGF 光密度值高于对照组(P<0.05)。见图6、表6。
表6 两组各时间点VEGF 光密度值比较[M(P25,P75)]
注VEGF:血管内皮生长因子。
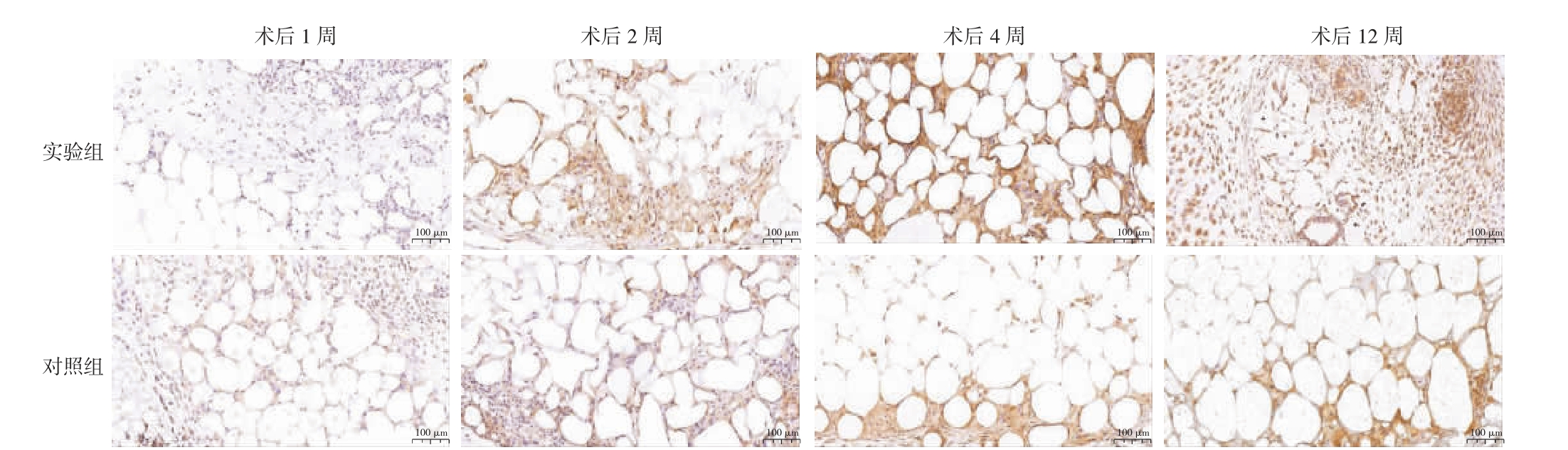
图6 两组移植物各时间点VEGF 免疫组织化学染色
VEGF:血管内皮生长因子。
3 讨论
与受区组织建立血供是脂肪移植物在受区成活的必要因素[8-10]。既往研究显示,透明质酸及其代谢产物可通过促血管新生提高脂肪移植后成活率[11-15]。CD31 和VEGF 是经典的血管内皮标志物,观察CD31(+)区域的血管分布情况可评估移植物内血管新生情况;而测定VEGF 光密度值则可量化VEGF 的分泌情况,进一步反映移植组织的血管新生能力[16-17]。本研究结果显示,术后12 周定制CLHA 完全代谢后,两组CD31(+)血管数量、VEGF 光密度值差异缩小,这可能与CLHA 代谢产物与透明质酸一致有关,其促血管新生的作用亦在完全代谢后逐渐减弱。然而,本研究显示,与对照组血管能长入移植物内部不同,实验组血管主要分布在移植物包膜上,鲜少长入中心部分。对此,笔者推断,CLHA 或仅能在其降解、代谢较旺盛的移植物外周促进血管新生,中心部血管新生则欠佳。Zheng 等[17]亦发现相同结果,因而不建议将脂肪直接注射到透明质酸中。此外,虽然CLHA 能促进外周血管新生,但实验组脂肪细胞完整性却较差,原因或在于CLHA 的物理阻隔仍会限制移植物的营养供应,整体而言弊大于利。Kim 等[18]发现酶解透明质酸后移植物与受区整合更佳,进而显著提升脂肪的成活率。值得注意的是,CLHA 的物理阻隔并未造成特别显著的脂肪组织坏死,甚至实验组油囊/空泡形成的数量少于对照组。造成这种结果的原因一方面在于CLHA 的物理阻隔使得移植物内只有数量少、应激耐受强的完整脂肪细胞(易于去分化)和脂肪干细胞可以存活,因而脂肪细胞完整性出现损伤[19-22];另一方面在于移植后早期炎症反应强、巨噬细胞活跃,坏死脂肪细胞能更快被清除,实验组移植物在术后12 周的组织保留率出现大幅下降亦进一步证实了该推测。
本研究中检测的Perilipin-1 是仅表达于活脂肪细胞内的脂滴表面的蛋白,可用于识别活脂肪细胞区域[20];然而,考虑到两组移植物间体积保留可能存在差距,单纯活脂肪细胞区域的多寡无法客观反映移植物内原有脂肪细胞的存活情况,本研究参考He 等[7]研究进一步测定了有效体积保持率。本研究结果显示,尽管实验组术后12 周Perilipin-1(+)活脂肪细胞占比与术后1 周时水平相当,但其移植物留存体积却明显降低,因而活脂肪细胞的绝对值实际较小、有效体积保持率较低,提示其移植物内活脂肪细胞的绝对保留情况较差,而这或又与其炎症和纤维化较严重密切相关[23-24]。炎症进程中,M1 型巨噬细胞可分泌利于脂肪成活的细胞因子[6];M2 型则参与组织重塑、降解细胞外基质[6,24-25];炎症迁延会干扰巨噬细胞极化、导致移植物纤维化[6,23-24]。与Zheng 等[17]的发现相左,本研究发现CLHA 与脂肪混合移植会明显降低移植物的有效体积保持率。然而,本研究局限于大体观察和组织学层面,欠缺深入的机制探讨,有待进一步探索交联剂具体影响,并在RNA 水平展开深入研究。
综上所述,CLHA 与脂肪组织共移植可促进移植物周边血管生成,但同时也会加重炎症反应、促进移植物纤维化,有碍于颗粒脂肪移植后的远期成活。因此,建议临床上待局部CLHA 完全代谢或预先透明质酸酶溶解后再行颗粒脂肪移植。
利益冲突声明:本文所有作者均声明不存在利益冲突。
[1]GUARISE C,BARBERA C,PAVAN M,et al.HA-based dermal filler:downstream process comparison,impurity quantitation by validated HPLC-MS analysis,and in vivo residence time study[J].J Appl Biomater Funct Mater,2019,17(3):2280800019867075.
[2]DE BOULLE K,GLOGAU R,KONO T,et al.A Review of the Metabolism of 1,4-Butanediol Diglycidyl Ether-Crosslinked Hyaluronic Acid Dermal Fillers[J].Dermatol Surg,2013,39(12):1758-1766.
[3]YANG Z,LI M,JIN S,et al.Fat Grafting for Facial Rejuvenation in Asians[J].Clin Plast Surg,2020,47(1):43-51.
[4]ZHANG X,HUANG B,YANG M,et al.Single session of combined microfat and subcision in the treatment of Grade 4 atrophicacnescars[J].JCosmetDermatol,2022,21(10):4254-4260.
[5]SYDNEY R.COLEMAN,RICCARDO F.MAZZOLA,LEE L.Q.PU.科尔曼脂肪注射:从填充到再生[M].韩雪峰,译.上海:上海科学技术出版社,2021.
[6]CAI J,FENG J,LIU K,et al.Early Macrophage Infiltration Improves Fat Graft Survival by Inducing Angiogenesis and Hematopoietic Stem Cell Recruitment[J].Plast Reconstr Surg,2018,141(2):376-386.
[7]HE Y,ZHANG X,HAN X,et al.The Importance of Protecting the Structure and Viability of Adipose Tissue for Fat Grafting[J].Plast Reconstr Surg,2022,149(6):1357-1368.
[8]XU M,HE Y,LI Y,et al.Combined Use of Autologous Sustained-Release Scaffold of Adipokines and Acellular Adipose Matrix to Construct Vascularized Adipose Tissue [J].Plast Reconstr Surg,2024,153(2):348e-360e.
[9]NGUYEN A,PASYK K A,BOUVIER T N,et al.Comparative study of survival of autologous adipose tissue taken and transplanted by different techniques[J].Plast Reconstr Surg,1990,85(3):378-389.
[10]TANG H H,HAN X L,DEBEL S H,et al.Fate of Free Fat Grafts with or without Adipogenic Adjuncts to Enhance Graft Outcomes[J].Plast Reconstr Surg,2018,142(4):939-950.
[11]HEMMRICH K,VAN DE SIJPE K,RHODES N P,et al.Autologous in vivo adipose tissue engineering in hyaluronan-based gels--a pilot study[J].J Surg Res,2008,144(1):82-88.
[12]ALGHOUL M,MENDIOLA A,SETH R,et al.The effect of hyaluronan hydrogel on fat graft survival [J].Aesthet Surg J,2012,32(5):622-633.
[13]ZHU Y,KRUGLIKOV I L,AKGUL Y,et al.Hyaluronan in adipogenesis,adipose tissue physiology and systemic metabolism[J].Matrix Biol,2019,78-79:284-291.
[14]MONTESANO R,KUMAR S,ORCI L,et al.Synergistic effect of hyaluronan oligosaccharides and vascular endothelial growth factor on angiogenesis in vitro[J].Lab Investig J Tech Methods Pathol,1996,75(2):249-262.
[15]ALTMANAM,ABDULKHALEKFJ,SEIDENSTICKERM,et al.Human tissue-resident stem cells combined with hyaluronic acid gel provide fibrovascular-integrated softtissue augmentation in a murine photoaged skin model [J].Plast Reconstr Surg,2010,125(1):63-73.
[16]陈啸,章宏伟,李平松.透明质酸对大鼠颗粒脂肪移植物存活影响的初步研究[J].中国美容医学,2014,23(21):1793-1798.
[17]ZHENG Z,LEI X,YANG Y,et al.Changes in Human Fat Injected Alongside Hyaluronic Acid in the Backs of Nude Mice[J].Aesthet Surg J,2021,41(6):NP631-NP642.
[18]KIM S K,YANG J Y,KIM C W,et al.The Effect of Hyaluronidase on the Fat Graft[J].J Craniofac Surg,2020,31(3):618-621.
[19]CHAI Y,CHEN Y,YIN B,et al.Dedifferentiation of Human Adipocytes After Fat Transplantation [J].Aesthet Surg J,2022,42(6):NP423-NP431.
[20]Chai Y,Jia X,Zhu J,et al.Increased Fat Graft Survival by Promoting Adipocyte Dedifferentiation [J].Aesthet Surg J,2023,43(3):NP213-NP222.
[21]ECKEL-MAHAN K,RIBAS LATRE A,KOLONIN M G.Adipose Stromal Cell Expansion and Exhaustion:Mechanisms and Consequences[J].Cells,2020,9(4):863.
[22]HARRIS W M,PLASTINI M,KAPPY N,et al.Endothelial Differentiated Adipose-Derived Stem Cells Improvement of Survival and Neovascularization in Fat Transplantation [J].Aesthet Surg J,2019,39(2):220-232.
[23]CHAPPELL A G,LUJAN-HERNANDEZ J,PERRY D J,et al.Alternatively Activated M2 Macrophages Im prove Autologous Fat Graft Survival in a Mouse Model through Induction of Angiogenesis [J].Plast Reconstr Surg,2015,136(2):277e.
[24]MINEDA K,KUNO S,KATO H,et al.Chronic inflammation and progressive calcification as a result of fat necrosis:theworstoutcomeinfatgrafting[J].PlastReconstr Surg,2014,133(5):1064-1072.
[25]CHEN Q,LIU S,CAO L,et al.Effects of macrophage regulation on fat grafting survival:Improvement,mechanisms,and potential application-A review[J].J Cosmet Dermatol,2022,21(1):54-61.