根据国际癌症研究机构的数据统计显示,2022年全球新发恶性肿瘤病例为2 000 万例,死亡人数高达970 万例[1]。恶性肿瘤已成为目前影响公共卫生健康的首要问题。转移是导致恶性肿瘤患者死亡的主要原因,也是治疗难点,如何有效阻止或抑制转移是恶性肿瘤治疗亟待解决的关键问题。ARHGDIB 是Rho GDP 解离抑制剂家族中研究最为深入且最为人熟知的成员,在几乎所有的哺乳动物器官中广泛表达,并能与多种Rho GTP 酶相互作用[2]。ARHGDIB 在多种恶性肿瘤侵袭和转移中发挥重要作用,因此,本文将论述ARHGDIB 在恶性肿瘤侵袭和转移中的研究进展,深入分析其作用机制,为今后的研究提供启示和思路。
1 ARHGDIB 的结构和功能
ARHGDIB 是Rho GTP 酶调节蛋白,其结构包括2 个N-末端SH3 结构域和1 个C-末端RhoGAP 结构域。Rho GTP 酶是一个高度保守的家族,调节一系列基本的细胞功能,其中最特别的功能是调节肌动蛋白的细胞骨架[3]。肌动蛋白细胞骨架的动态重组可改变细胞的伸长和运动,从而增加迁移。ARHGDIB 在细胞内调节Rho 家族GTP 酶家族的活性,从而影响细胞的迁移、侵袭和转移[4]。ARHGDIB 的结构与功能密切相关,ARHGDIB 的C-末端RhoGAP 结构域可催化RhoA 的GTP 水解,使其从活性状态转化为无活性状态,而2 个SH3 结构域则可结合一系列结构域,如PIPK,从而参与多种细胞活动[5]。
2 ARHGDIB 参与调控Rac 信号通路的机制
RHO(Ras 同源)家族是鸟嘌呤核苷酸结合蛋白Ras 超家族的一个组成部分。Rho GTP 酶属于Ras 蛋白超家族成员。RhoA、Cdc42、Rac1 是3 个研究最为透彻的Rho GTP 酶,在化学或机械刺激下传递信号,调节不同的信号通路[6-9]。其中Rac1 在许多恶性肿瘤中被扩增,具有促进肿瘤发生的作用[10]。ARHGDIB 是一种Rho GTP 酶抑制剂,通过调节细胞内Rho GTP 酶的活性,影响细胞的形态、黏附和迁移,从而参与多种信号通路及对恶性肿瘤细胞迁移和侵袭的调节。
2.1 ARHGDIB 与膀胱癌
ARHGDIB 在肿瘤细胞中通过各种途径对Rac1的调节较常见,特别是在膀胱癌研究中具体机制较为清楚。膀胱癌是一种常见的泌尿系统恶性肿瘤,在世界范围内有较高的发病率和死亡率。膀胱癌可频繁发生遗传改变,组蛋白去甲基化酶基因KDM6A 常在膀胱癌中发生突变[11]。研究表明,KDM6A 在膀胱癌中具有肿瘤抑制作用[12]。Liu 等[13]通过过表达膀胱癌细胞中的KDM6A 进行细胞Transwell 和侵袭实验,发现KDM6A 稳定过表达可显著降低细胞的迁移和侵袭能力;对过表达KDM6A 的细胞进行RNA 测序分析显示,ARHGDIB 是前10 位基因之一;功能实验结果显示,KDM6A 的敲低可降低ARHGDIB 的表达;裸鼠皮下肿瘤模型中免疫组织化学染色结果进一步证实KDM6AARHGDIB 作用轴;临床标本研究中同样证实,KDM6A与ARHGDIB 水平呈正相关。随后研究发现,KDM6A通过上调ARHGDIB 抑制Rac1,从而抑制肿瘤转移,提示ARHGDIB 在膀胱癌转移中具有重要作用[13]。此外,研究发现FOXA1 可结合KDM6A 的启动子区,激活KDM6A 的转录,从而促进ARHGDIB 的表达,抑制膀胱癌细胞的迁移和侵袭,表明FOXA1 通过上调KDM6A-ARHGDIB 轴抑制膀胱癌转移[13]。见图1。转移是恶性肿瘤死亡的主要原因,转移机制对癌症诊断、治疗和预后至关重要,KDM6A-ARHGDIB 轴的发现可为膀胱癌治疗提供新的靶点。
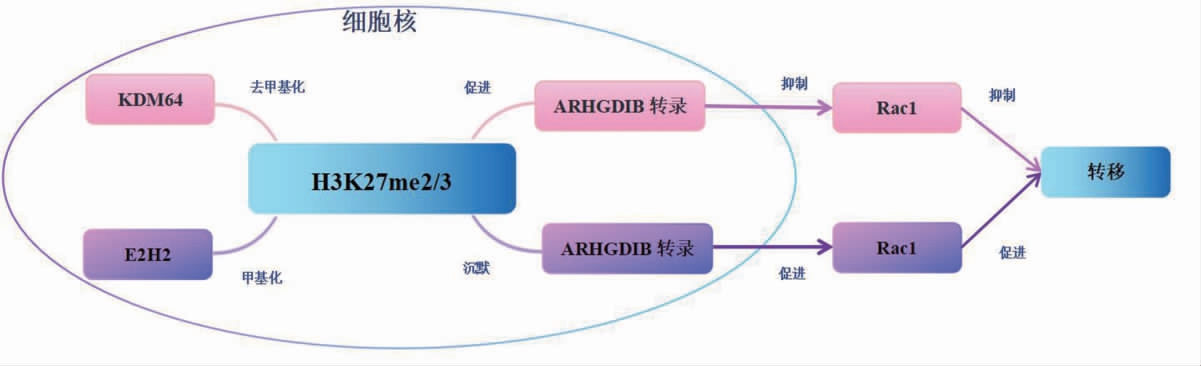
图1 ARHGDIB 在膀胱癌中影响转移的机制
2.2 ARHGDIB 与胃癌
Cho 等[14]在胃癌SNU-484 和SNU-719 细胞中建立ARHGDIB 过表达的细胞,结果发现ARHGDIB 过表达促进细胞的侵袭性;相反,ARHGDIB 表达缺失抑制细胞的侵袭性。Zeng 等[15]对ARHGDIB 被敲除的胃癌细胞MGC803 和SGC7901 进行划痕实验和Transwell 实验,结果显示ARHGDIB 的下调明显抑制细胞迁移;相反,ARHGDIB 的上调明显促进细胞迁移和侵袭;胃癌患者中还发现ARHGDIB 的表达水平与Rac1、PaK1 和L1MK1 表达水平呈正相关。在胃癌细胞系中靶向ARHGDIB 的miRNA 转染后,用RT-PCR、Western blot 法检测Rac1、PaK1 和L1MK1 表达,结果显示ARHGDIB 的抑制可显著降低Rac1、PaK1 和L1MK1 表达,提示ARHGDIB 的抑制可下调Rac1/PaK1/L1MK1通路。ARHGDIB/Rac1/PaK1/L1MK1 轴对胃癌的转移和侵袭有重要的调控作用。见图2。
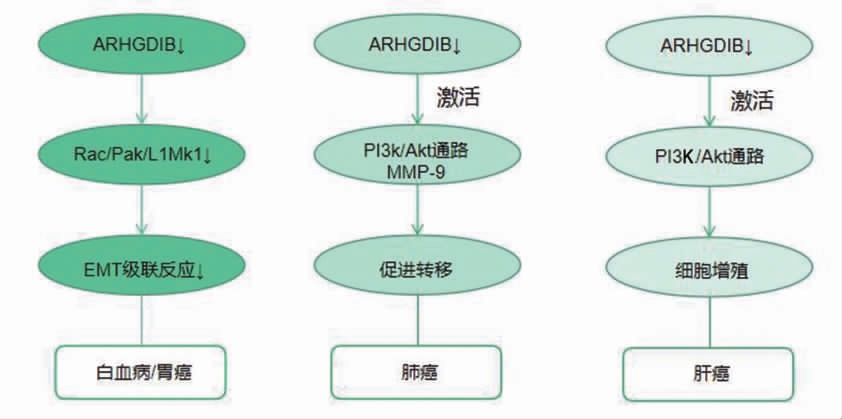
图2 ARHGDIB 在恶性肿瘤中对信号通路的影响作用
MMP-9:基质金属蛋白酶-9;EMT:上皮-间充质转化。
2.3 ARHGDIB 与白血病
ARHGDIB 在白血病中的作用机制与胃癌相似。Hui 等[16]通过高分辨率质谱分析发现大蒜的有效成分,提示二烯丙基二硫醚可降低APL HL-60 细胞中ARHGDIB 的性能,提示二烯丙基二硫醚可抑制白血病细胞中ARHGDIB 表达。二烯丙基二硫醚可通过Rac1/PaK1/L1MK1 通路抑制上皮间质转化反应,为探究ARHGDIB 与Rac1/PaK1/L1MK1 通路的关系,研究沉默基因ARHGDIB 对二烯丙基二硫醚处理的HL-60 细胞中Rac1-PaK1-L1MK1 通路的影响,Western blot 结果显示,明沉默组的Rac1、PaK1、L1MK1蛋白表达水平下降。二烯丙基二硫醚可通过降低ARHGDIB 的表达负向调节Rac1/PaK1/L1MK1 信号通路,从而抑制白血病细胞的增殖、转移等恶性生物学行为。见图2。因此,抑制ARHGDIB 的表达可能是治疗白血病的一个新治疗方向。
综上,ARHGDIB 的表达可调节Rac1 信号通路从而促进或抑制肿瘤转移,在膀胱癌、胃癌和白血病中得到证实,表明ARHGDIB 在癌症转移预防和治疗中有广阔的应用前景。ARHGDIB 的应用有望成为一种新的治疗手段,通过调节其在信号通路中的作用影响肿瘤细胞的迁移和侵袭,从而抑制肿瘤的发展。
3 ARHGDIB 参与调控PI3K/Akt 信号通路的机制
3.1 ARHGDIB 与肺癌
Niu 等[17]通过免疫组织化学染色分析ARHGDIB在各种临床肺癌标本中的表达水平,结果显示ARHGDIB 表达下调与肺癌细胞的分化程度和淋巴结转移倾向呈负相关,提示ARHGDIB 可参与肺癌转移和侵袭。为进一步研究ARHGDIB 在肺癌中转移和侵袭的潜在机制和作用靶点,Niu 等[18]将表达shRNA 的质粒转染至肺癌A549 细胞中抑制ARHGDIB 的表达,MTT 实验和克隆实验结果显示,ARHGDIB 的下调使肺癌细胞增殖更快;划痕定量实验显示,与A549和shRNA 细胞比较,ARHGDIB shRNA 细胞在12、24 h的迁移量分别增加18%、14%。Matrigel 侵袭实验同样显示,在24 h 内,更多的ARHGDIB shRNA 细胞发生迁移,提示ARHGDIB 可抑制肺癌细胞的迁移和侵袭。PI3K 可诱导细胞生长和增殖,间质转化相关基因基质金属蛋白酶(matrix metallopeptidase,MMP)-9 是PI3K/Akt 通路的下游靶点,参与肿瘤进展的各个阶段,特别是通过降解细胞外基质和基底膜蛋白的主要成分促进肿瘤的侵袭和转移过程。MMP-9 的表达水平升高在肿瘤转移中起重要作用。为研究ARHGDIB在肺癌中如何影响MMP-9,Niu 等[17]在A549、对照shRNA 细胞和ARHGDIB shRNA 细胞系中检测MMP-9 的表达水平,结果显示ARHGDIB 的下调可显著增强MMP-9 在mRNA 和蛋白水平上的表达,提示肺癌细胞中ARHGDIB 与MMP-9 呈负相关。shRNA 下调ARHGDIB 后,检测PI3K 亚基(p85α 和p110α)、下游靶点Akt 和磷酸化Akt 的表达水平,结果显示Akt 磷酸化水平升高,p85α 和p110α 表达增加。LY294002 抑制剂阻断PI3K/Akt 通路导致p-Akt和MMP-9 的表达降低,抑制ARHGDIB shRNA 细胞系的侵袭和转移,表明ARHGDIB 下调通过激活PI3K/Akt 通路,可增加肺癌的迁移和侵袭能力。见图2。
3.2 ARHGDIB 与肝癌
Fang 等[19]用qRT-PCR 检测64 例肝细胞癌及匹配的邻近非肿瘤组织中ARHGDIB mRNA 的表达水平,结果显示肝癌样本中mRNA 的表达水平明显高于匹配的邻近非肿瘤组织。为研究ARHGDIB 在肝细胞癌中的生物学作用,Fang 等[19]对过表达的ARHGDIB细胞进行MTT 实验和Transwell 实验,结果显示ARHGDIB 可增加肝癌细胞的增殖和侵袭能力。MMP是众所周知的细胞外基质降解酶,已被证明参与肿瘤的侵袭和转移,MMP-9 是目前已知的肝癌转移标志物之一[20]。采用Western blot 法检测过表达ARHGDIB的Huh7 和7721 细胞中MMP-2 和MMP-9 的表达水平,结果显示ARHGDIB 的过表达可显著提高MMP-2 和MMP-9 的表达水平,提示ARHGDIB 通过提高MMP-2 和MMP-9 的表达水平促进细胞迁移和侵袭。既往研究表明,PI3K/Akt 信号通路通过调控MMP-2 和MMP-9 在肝癌细胞的侵袭与迁移中发挥重要作用;而过表达的ARHGDIB 可显著提高Huh7和7721 细胞中p-Akt 蛋白的表达水平。ARHGDIB 在肝细胞癌细胞中激活磷酸化Akt,用抑制剂LY294002阻断PI3K/Akt 信号通路,发现ARHGDIB 诱导的磷酸化被抑制,MMP-2 和MMP-9 表达水平减弱,同时侵袭水平减弱,提示ARHGDIB 通过激活PI3K/Akt 通路促进肝癌细胞侵袭,上调MMP-2 和MMP-9 的表达。见图2。
3.3 ARHGDIB 与胰腺导管腺癌
ARHGDIB 参与胰腺导管腺癌侵袭的机制与肝细胞癌相似[21]。ARHGDIB 的过表达通过激活PI3K/Akt通路和MMP-2 和MMP-9 表达增加胰腺导管腺癌的侵袭。
综上,ARHGDIB 可通过Rac1 和PI3K/Akt 信号通路影响多种恶性肿瘤的侵袭和转移。肺癌、肝癌及胰腺导管腺癌中ARHGDIB 表达可影响MMP-9 表达,目前MMP-9 已被广泛发现与癌症的病理学有关,包括但不限于侵袭、转移和血管生成。众所周知,转移是恶性肿瘤难以治愈的首要难题,因此继续探究ARHGDIB 影响MMP-9 和Rac1 和PI3K/Akt 信号通路的具体机制可为肿瘤的治疗提供新的思路。
4 ARHGDIB 在其他恶性肿瘤中的作用
4.1 ARHGDIB 与乳腺癌
郭欠影[22]采用免疫组织化学染色法检测ARHGDIB在100 例乳腺癌组织和100 例乳腺良性组织中的表达情况,结果显示ARHGDIB 在乳腺癌组织中的表达显著高于乳腺良性组织;进一步研究发现敲低ARHGDIB 后,可显著抑制乳腺癌细胞的增殖、迁移和侵袭能力。在乳腺癌耐药中,郭欠影等[23]沉默ARHGDIB 的表达,并检测阿霉素耐药细胞株MCF-7/ADR 对化疗药物阿霉素的敏感性,结果显示阿霉素耐药细胞株MCF-7/ADR 中ARHGDIB 的mRNA 和蛋白水平均升高,提示沉默ARHGDIB 可增强乳腺癌细胞对阿霉素的敏感性。Wang 等[24]通过实验发现ARHGDIB 的表达与乳腺癌患者肿瘤大小、淋巴结转移和TNM 分期呈正相关。因此,ARHGDIB 的高表达提示乳腺癌患者预后不良。
4.2 ARHGDIB 与结直肠癌
有研究采用RT-PCR、Western blot、免疫组织化学染色法等检测ARHGDIB 在结直肠癌细胞系、20 例匹配的新鲜结直肠癌组织和120 例临床石蜡包埋结直肠癌组织中的表达,结果发现ARHGDIB 在高转移结直肠癌细胞系中的表达高于低转移[25];进一步实验显示ARHGDIB 的过表达可增加结直肠癌细胞的增殖和侵袭,提示ARHGDIB 可为临床结直肠癌患者提供新的治疗靶点。此外,ARHGDIB 的表达与肿瘤大小、分化和分期密切相关,表明ARHGDIB 可预测早期患者的预后指标。
5 ARHGDIB 在肿瘤微环境中的作用
ARHGDIB 不仅作为一个重要的信号通路调节因子抑制肿瘤转移,在肿瘤微环境中也能发挥抑制肿瘤转移的作用。肿瘤微环境中的炎症因子可受ARHGDIB表达的影响,如趋化因子CCL2 和巨噬细胞。硫酸软骨素蛋白多糖2 在侵袭性和转移性肿瘤组织中高表达,V0、V1、V2、V3 异构体或剪接变体可促进恶性肿瘤细胞的增殖、黏附和迁移。趋化因子CCL2 和巨噬细胞是硫酸软骨素蛋白多糖2 发挥促转移作用所必需的,硫酸软骨素蛋白多糖2 是恶性肿瘤相关炎症的核心部分,其可为炎症细胞和癌细胞提供一套复杂的环境信号。研究显示,ARHGDIB 的转移抑制活性依赖于硫酸软骨素蛋白多糖2 变体表达减少,提示肿瘤转移抑制因子ARHGDIB 可阻断远处器官的前转移性炎症宿主反应,ARHGDIB 可通过改变肿瘤微环境中的炎症抑制转移[26]。在肿瘤微环境中,ARHGDIB 还可诱导肿瘤血管生成、细胞间相互作用等生物过程,从而增加肿瘤转移的可能性。因此,ARHGDIB 作为一种重要的肿瘤转移标志物,在肿瘤治疗中具有巨大的研究和应用价值。未来的研究中,需深入探索其在肿瘤微环境中的作用机制及如何将其用于抗癌药物的开发和临床应用,从而为肿瘤患者提供更有效和个性化的治疗方案。
6 小结
早期研究认为ARHGDIB 的作用是抑制恶性肿瘤转移,随着研究的不断深入,发现ARHGDIB 在不同恶性肿瘤中作用相反,其具有促进和抑制肿瘤转移和侵袭的双重作用。如肺癌、膀胱癌和霍奇金淋巴瘤中,ARHGDIB 过表达可抑制肿瘤细胞的转移和侵袭;相反,在胃癌、乳腺癌、结直肠癌中过表达ARHGDIB可促进肿瘤细胞的转移和侵袭。此外,ARHGDIB 可通过对多种信号通路的调节间接促进或抑制肿瘤细胞的转移和侵袭,但目前仅膀胱癌的信号通路研究较为透彻,其余恶性肿瘤中ARHGDIB 发挥作用的信号通路具体机制仍有待进一步研究。
对ARHGDIB 未来的研究,从以下两方面进行:第一,进一步研究ARHGDIB 与其他基因的调控机制及信号通路,深刻阐明其在恶性肿瘤转移中的作用机制,为开发更高效的肿瘤靶向治疗药物提供依据;第二,加强多学科交流与合作,从不同维度、跨学科综合研究寻找ARHGDIB 在恶性肿瘤预防和治疗方面的应用前景,共同推动恶性肿瘤治疗的进步。
综上所述,本文对ARHGDIB 在恶性肿瘤转移中的重要作用和机制进行归纳,总结其在恶性肿瘤转移中的不同作用机制,为今后研究恶性肿瘤转移提供新思路和好建议。
利益冲突声明:本文所有作者均声明不存在利益冲突。
[1]BRAY F,LAVERSANNE M,SUNG H.Global cancer statistics 2022:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J].CA Cancer J Clin,2024,74(3):229-263.
[2]DERMARDIROSSIAN C,BOKOCH G M.GDIS:central regulatory molecules in Rho GTPase activation [J].Trends Cell Biol,2005,15(7):356-363.
[3]KARDOL-HOEFNAGEL T,VAN LOGTESTIJN S A L M,OTTEN H G.A review on the function and regulation of ARHGDIB/RhoGDI2 expression including the hypothetical role of ARHGDIB/RhoGDI2 autoantibodies in kidney transplantation[J].Transplant Direct,2020,6(5):e548.
[4]KREIDER-LETTERMANG,CARRNM,GARCIA-MATAR.Fixing the GAP:the role of RhoGAPs in cancer [J].Eur J Cell Biol,2022,101(2):151209.
[5]BURRIDGE K,WENNERBIGE K.Rho and Rac take center stage[J].Cell,116(2):167-179.
[6]MOSADDEGHZADEH N,AHMADIAN M R.The RHO family GTPases:mechanisms of regulation and signaling [J].Cells,2021,10(7):1831-1855.
[7]MAGALHAES Y T,FARIAS J O,SILVA L E,et al.GTPases,genome,actin:a hidden story in DNA damage response and repair mechanisms[J].DNA Repair(Amst),2021,100:103070.
[8]MALDONADO M D M,MEDINA J I,VELAZQUZE L,et al.Targeting Rac and Cdc42 GEFs in metastatic cancer [J].Front Cell Dev Biol,2020,8:201.
[9]BAGCI H,SRISKANDARAJAH N,ROBERT A,et al.Mapping the proximity interaction network of the Rho-family GTPases reveals signalling pathways and regulatory mechanisms[J].Nat Cell Biol,2020,22(1):120-134.
[10]SVENSMARK J H,BRAKEBUSCH C.Rho GTPases in cancer:friend or foe? [J].Oncogene,2019,38(50):7447-7456.
[11]MATER M,PRINCE G,HAMATI I,et al.Implication of KDM6A in bladder cancer[J].Pharmacogenomics,2023,24(9):509-522.
[12]KANEKO S,LI X.X chromosome protects against bladder cancer in females via a KDM6A-dependent epigenetic mechanism[J].Sci Adv,2018,4(6):eaar5598.
[13]LIU L,CUI J,ZHAO Y,et al.KDM6A-ARHGDIB axis blocks metastasis of bladder cancer by inhibiting Rac1 [J].Mol Cancer,2021,20(1):77.
[14]CHO H J,BAEK K E,PARK S M,et al.RhoGDI2 expression is associated with tumor growth and malignant progression of gastric cancer [J].Clin Cancer Res,2009,15(8):2612-2619.
[15]ZENG Y,REN M,LI Y,et al.Knockdown of RhoGDI2 represses human gastric cancer cell proliferation,invasion and drug resistance via the Rac1/Pak1/LIMK1 pathway[J].Cancer Left,2020,492(2018):136-146.
[16]HUI T,YILING J,GUANGQUN C,et al.Diallyl disulfide downregulating RhoGDI2 induces differentiation and inhibit invasion via the Rac1/Pak1/LIMK1 pathway in human leukemia HL-60 cells [J].Environ Toxicol,2023,38(5):1063-1077.
[17]NIU H,LI H,XU C,et al.Expression profile of RhoGDI2 in lung cancers and role of RhoGDI2 in lung cancer metastasis[J].Oncol Rep,2010,24(2):465-471.
[18]NIU H,WU B,PENG Y,et al.RNA interference-mediated knockdown of RhoGDI2 induces the migration and invasion of human lung cancer A549 cells via activating the PI3K/Akt pathway[J].Tumour Biol,2015,36(1):409-419.
[19]FANG Y,YI J,LIZHI L,et al.Rho GDP dissociation inhibitor beta promotes cell proliferation and invasion by modulating the AKT pathway in hepatocellular carcinoma[J].DNA Cell Biol,2014,33(11):781-786.
[20]YU X,HUANG J,WU S,et al.Copy number variations of MMP-9 are prognostic biomarkers for hepatocellular carcinoma[J].Transl Cancer Res,2020,9(2):698-706.
[21]YI B,HU Y,QIN G,et al.Depletion of RhoGDI2 expression inhibits the ability of invasion and migration in pancreatic carcinoma[J].Int J Mol Med,2014,34(1):205-212.
[22]郭欠影.ARHGDIB 在乳腺癌中的表达及其作用[D].合肥:安徽医科大学,2019.
[23]郭欠影,汪碧君,吴正升.沉默ARHGDIB 对乳腺癌细胞阿霉素耐药的影响[J].临床与实验病理学杂志,2019,35(5):505-509.
[24]WANG X,BI X,HUANG X,et al.Systematic investigation of biomarker-like role of ARHGDIB in breast cancer [J].Cancer Biomark,2020,28(1):101-110.
[25]BAIDOUN F,ELSHIWY K,ELKERAIE Y,et al.Colorectal cancer epidemiology:recent trends and impact on outcomes[J].Curr Drug Targets,2021,22(9):998-1009.
[26]SAID N,SANCHEZ-CARBAYO M,SMITH S C,et al.Rho-GDI2 suppresses lung metastasis in mice by reducing tumor versican expression and macrophage infiltration [J].J Clin Invest,2012,122(4):1503-1518.