甲状腺激素对新生儿的生长发育具有重要作用,对各个系统的功能几乎都有影响,特别是对中枢神经系统的发育至关重要。甲状腺功能减退会引起智能发育落后、生长发育迟缓、生理功能低下等临床表现,危害性强[1]。孕36~40 周前甲状腺尚不存在自身调节机制,同时,下丘脑-垂体-甲状腺轴的成熟始于妊娠后期,直至生后3 个月其反馈调节功能才达到成熟[2]。因此,早产儿生后甲状腺功能虽在性质上与足月儿相似,但在数量上较足月儿低,更易发生甲状腺功能异常[3]。近年来随着围生医学的发展,极早产儿或超早产儿成活率越来越高,早产儿甲状腺功能异常越来越受到围生医学界的关注。因此,了解早产儿甲状腺功能的影响因素,及时采取预防措施,对改善早产儿预后具有重要意义。本研究对生后7 d 早产儿甲状腺功能及其影响因素进行研究。
1 对象与方法
1.1 研究对象
回顾性分析2023 年3 月至8 月出生并入住山西医科大学附属山西省儿童医院新生儿内科的261 例早产儿的临床资料。纳入标准:①在山西医科大学附属山西省儿童医院出生,胎龄<37 周;②生后第7 天完善甲状腺功能五项[促甲状腺激素(thyroid-stimulatinghormone,TSH)、游离甲状腺素(freethyroxine,FT4)、总甲状腺素、游离三碘甲状腺原氨酸、总三碘甲状腺原氨酸]检查。排除标准:①伴有宫内窘迫及生后窒息史;②伴有甲状腺器质性病变;③伴有严重畸形、遗传代谢病[4];④完善甲状腺功能五项检查前接受过甲状腺素治疗;⑤孕妇有化学物质(一些酚类和邻苯二甲酸盐)接触史;⑥资料不完整。本研究经山西省儿童医院医学伦理委员会批准(IRB-WZ-2024-009)。
1.2 研究方法
1.2.1 一般资料及临床资料收集 记录早产儿及母亲临床资料。收集早产儿的一般资料(胎龄、出生体重、胎数、分娩方式、受孕方式);母亲孕期疾病(孕期甲状腺功能异常、妊娠糖尿病、妊娠高血压);早产儿治疗药物[抗生素、肺表面活性物质(pulmonary surfactant,PS)、利尿药、脂肪乳剂、苯巴比妥、枸橼酸咖啡因];合并症[呼吸窘迫综合征(respiratory distress syndrome,RDS)、动脉导管未闭(patent ductus arteriosus,PDA)、败血症]。
早产儿生后7 d 采集静脉血,采用西门子XP 及化学发光法测定早产儿的甲状腺功能五项(型号:ADVIA Centour XP,生产商:美国西门子医学诊断股份有限公司;试剂盒货号:04779663,生产商:美国西门子医学诊断股份有限公司)。
1.2.2 诊断标准及分组 参考第5 版《实用新生儿学》[2]诊断标准。①早产儿暂时性甲状腺功能减低症(transiant hypothyroxinemia of prematurity,THOP):TSH 正常或偏低,FT4<0.8 ng/dl;②高TSH 血症:FT4 正常,TSH>10 mIU/L。根据生后7 d 甲状腺功能检查结果分为正常组和异常组,其中异常组包括THOP 及高TSH 血症。
1.3 统计学方法
采用SPSS 27.0 统计学软件进行数据分析。计数资料用例数和百分率表示,比较采用χ2 检验。早产儿生后7 d 甲状腺功能异常的影响因素采用logistic 回归分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 早产儿生后7 d 甲状腺功能情况
早产儿生后7 d 甲状腺功能异常53 例(20.3%),其中THOP 25 例,高TSH 血症28 例。
2.2 早产儿生后7 d 甲状腺功能异常的单因素分析
两组胎龄、出生体重、分娩方式、妊娠高血压、使用PS、使用脂肪乳剂、合并PDA 比较,差异有统计学意义(P<0.05)。见表1。
表1 早产儿生后7 d 甲状腺功能异常的单因素分析[例(%)]
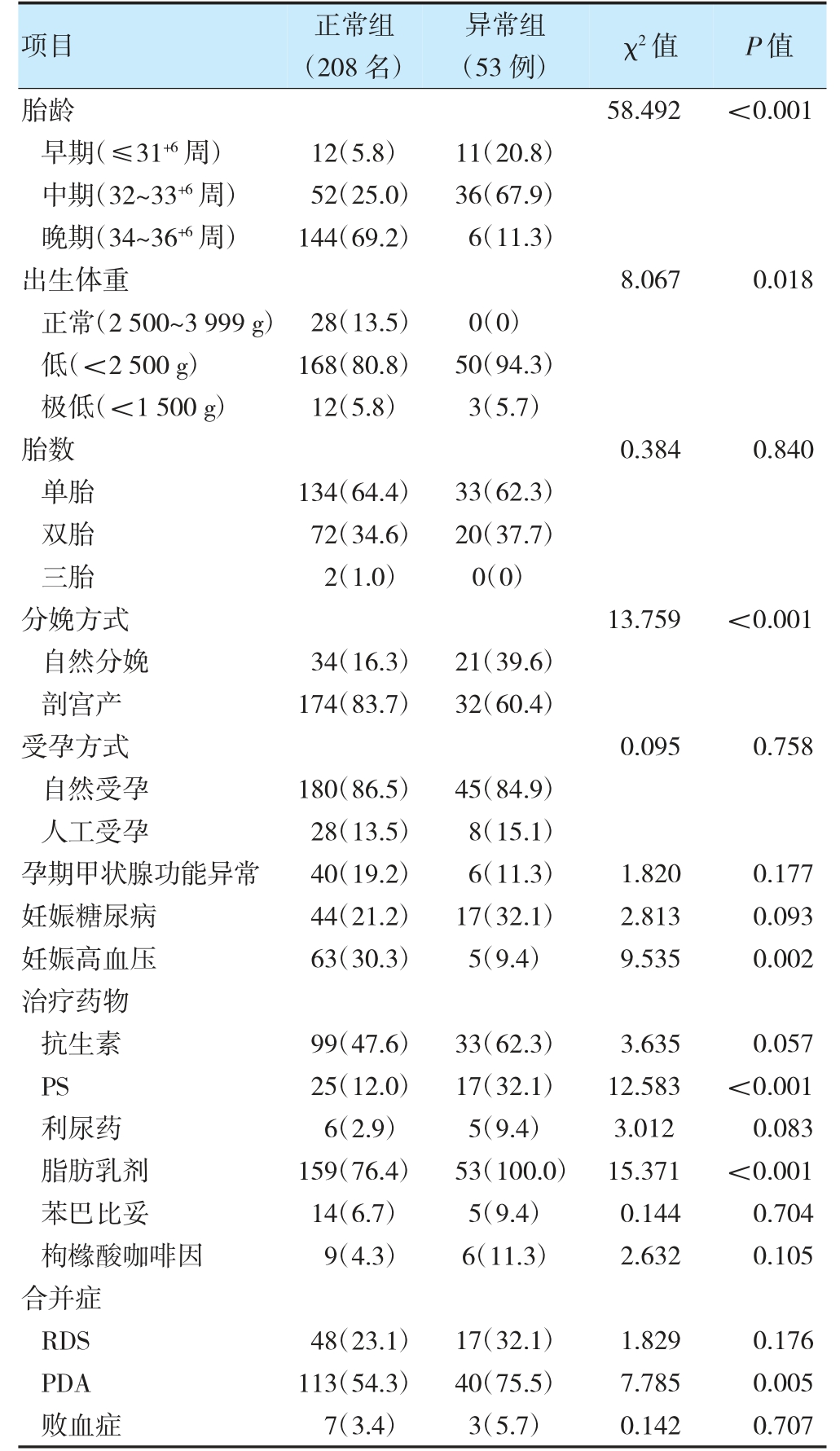
注PS:肺表面活性物质;RDS:呼吸窘迫综合征;PDA:动脉导管未闭。
2.3 早产儿生后7 d 甲状腺功能异常的多因素分析
共线性分析结果显示,出生体重、妊娠高血压、使用脂肪乳剂存在共线性,另外为了降低误差,使结论更加可靠,且结合临床实际,最终选取胎龄、分娩方式、使用PS 和合并PDA 进行多因素分析。
以早产儿生后7 d 甲状腺功能为因变量(正常=0,异常=1),以胎龄[早期(≤31+6 周)=1,中期(32~33+6周)=2,晚期(34~36+6 周)=3]、分娩方式(自然分娩=0,剖宫产=1)、使用PS(是=0,否=1)和合并PDA(是=0,否=1)为自变量进行多因素logistic 回归分析。结果显示,胎龄(OR=0.187)、分娩方式(OR=0.197)、合并PDA(OR=0.251)是早产儿生后7 d 甲状腺功能异常的影响因素(P<0.05)。见表2。
表2 早产儿生后7 d 甲状腺功能异常的多因素分析
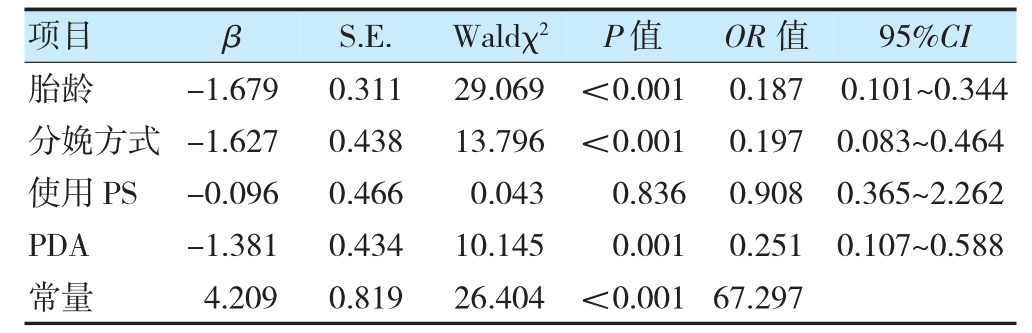
注PS:肺表面活性物质;PDA:动脉导管未闭。
3 讨论
研究指出,与TSH 升高延迟相关的低甲状腺素血症在早产儿中较为多见[3];暂时性甲状腺功能减退的发生率与胎龄密切相关[5-6];早产儿甲状腺功能异常的发生率与胎龄呈负相关[7]。本研究结果显示,胎龄是早产儿生后7 d 甲状腺功能异常的影响因素,提示胎龄越小,越易引起甲状腺功能异常。可能的原因:①甲状腺组织的重量与胎龄相关,早产儿的甲状腺较小,妊娠24~32 周早产儿的平均甲状腺重量为0.44 g,而足月儿为1.79 g,这会导致碘储存能力下降,甲状腺激素的产生减少[3,8];②早产儿下丘脑-垂体-甲状腺轴发育不成熟,容易引起甲状腺功能异常[9];③孕妇通过脐带转运甲状腺激素,且胎盘可产生大量活性物质影响胎儿甲状腺功能,早产儿此途径中断太早从而易引起甲状腺功能减退[10];④胎龄越小,消化道发育越不成熟,长期肠外营养会导致碘缺乏,从而引起甲状腺功能异常[11]。
出生体重越低,暂时性先天性甲状腺功能减低症的患病率越高[12]。Larson 等[13]研究结果提示,极低出生体重新生儿先天性甲状腺功能减低症的发生率是非极低出生体重新生儿的14 倍,且2/3 的极低出生体重新生儿初筛呈阴性,极低出生体重新生儿TSH 延迟升高的风险显著高于新生儿的发生风险(分别为1∶400 和1∶24 260)。有研究分析不同出生体重早产儿的甲状腺功能,发现出生体重与TSH 呈负相关[14];卢晓燕等[15]研究也有相同结论,考虑可能与下丘脑-垂体-甲状腺轴发育不成熟有关[16]。此外,极低出生体重儿常合并RDS、PDA 等非甲状腺疾病综合征,可影响甲状腺功能。本研究结果显示,两组出生体重比较,差异有统计学意义(P<0.05),出生体重越低,越容易发生甲状腺功能异常,与上述文献所得出的结论一致。有研究显示,单胎与多胎会影响早产儿的甲状腺功能[17]。本研究结果显示,两组胎数比较,差异无统计学意义(P>0.05),出现这种情况可能与本研究中纳入的样本量不足有关。本研究结果显示,两组分娩方式比较,差异有统计学意义(P<0.05),且分娩方式是早产儿生后7 d 甲状腺功能异常的影响因素。与剖宫产比较,阴道分娩会导致脐带TSH 水平更高,可能与分娩应激导致儿茶酚胺增加有关[18]。
孕期甲状腺疾病相对常见,增加早产儿进入重症监护室的风险[19]。研究发现,孕妇TSH 和新生儿TSH水平相关,孕期甲状腺疾病会影响早产儿甲状腺功能[20-23]。甲状腺癌孕妇虽未发现对新生儿TSH 有不良影响,但对后代长期甲状腺功能的影响有待进一步研究[24]。可能的原因:①孕妇甲状腺素不足,通过胎盘提供给胎儿的甲状腺素少,引起胎儿TSH 水平上升;②甲状腺功能减退症孕妇体内促甲状腺激素释放激素上升,直接刺激胎儿引起TSH 水平上升。本研究结果显示,两组孕期甲状腺功能异常比较,差异无统计学意义(P>0.05),与上述文献所得结论不同,故后续研究可进一步探究孕妇甲状腺功能异常的程度及是否规律治疗对早产儿甲状腺功能的影响。
妊娠糖尿病和妊娠高血压增加不良分娩的可能性,对胎儿早期发育有负面影响,导致甲状腺发育异常或功能不成熟,从而增加甲状腺功能异常的发病风险[25-26]。研究显示,妊娠高血压是早产儿甲状腺功能异常的影响因素[27]。本研究结果显示,两组妊娠糖尿病比较,差异无统计学意义(P>0.05),后续研究可进一步完善孕妇妊娠糖尿病的严重程度;两组妊娠高血压比较,差异有统计学意义(P<0.05),与上述结果一致。
本研究结果显示,两组使用PS 比较,差异有统计学意义(P<0.05),而使用PS 不是早产儿生后7 d 甲状腺功能异常的影响因素。提示可进一步研究PS 的种类及给药方式等对早产儿甲状腺功能的影响。血清中游离脂肪酸水平升高会影响早产儿甲状腺功能[9]。本研究结果显示,两组使用脂肪乳剂比较,差异有统计学意义(P<0.05),提示使用脂肪乳剂可能影响早产儿甲状腺功能。目前国内外鲜有此方面的研究,故可进一步探究脂肪乳剂使用量及使用时间等对早产儿甲状腺功能的影响。
RDS、败血症等疾病会对早产儿的甲状腺功能产生负面影响[28]。血清中三碘甲状腺原氨酸极小一部分是由甲状腺分泌,极大部分由甲状腺素在外周转变而成,任何导致新生儿缺氧的疾病均有可能阻碍血清中甲状腺素转变为三碘甲状腺原氨酸,导致血清三碘甲状腺原氨酸水平降低,从而发生甲状腺功能异常[28]。本研究结果显示,两组合并RDS、败血症比较,差异无统计学意义(P>0.05);两组合并PDA 比较,差异有统计学意义(P<0.05)且合并PDA 是早产儿生后7 d甲状腺功能异常的影响因素。
综上所述,早产儿生后7 d 甲状腺功能受多种因素影响,针对不同因素进行干预,增强孕产期的早期预防、早期筛查、早期诊断和治疗,有重要意义。国内外关于新生儿甲状腺功能影响因素的研究较多,早产儿这一群体更易发生甲状腺功能异常,此方面研究仍较少,本文对早产儿生后早期甲状腺功能的影响因素研究涉及面广泛且新颖,且本研究所有数据均采用最先进的检测方法获得,具有很大的参评和实用价值。但由于本研究为单中心研究,样本量较小,存在地区差异,且未能对孕妇甲状腺功能的严重程度等进行分层分析,存在一定的局限性,尚需开展多中心、大样本量研究予以评估。
利益冲突声明:本文所有作者均声明不存在利益冲突。
[1]孙锟,沈颖.小儿内科学[M].北京:人民卫生出版社,2019:482.
[2]邵肖梅,叶鸿瑁,丘小汕.实用新生儿学[M].5 版.北京:人民卫生出版社,2019:922.
[3]ZDRAVESKA N,KOCOVA M.Thyroid function and dysfunction in preterm infants-Challenges in evaluation,diagnosis and therapy [J].Clin Endocrinol(Oxf),2021,95(4):556-570.
[4]FELDMAN P M,RODRIGUEZ N,MORRISON E,et al.Prospective study of thyroid function in the first year of life in infants with Down syndrome[J].Eur J Pediatr,2023,182(6):2903-2911.
[5]JO H Y,YANG E H,KIM Y M,et al.Incidence of congenital hypothyroidism by gestational age:a retrospective observational study[J].J Yeungnam Med Sci,2023,40(1):30-36.
[6]刘利军.新生儿暂时性低甲状腺素血症的影响因素及甲状腺素替代治疗的效果评估[J].江西医药,2022,57(12):2186-2187,2190.
[7]CHEN S,LU X,YANG B,et al.Developmental Trends in Postnatal Thyroid Hormones and Thyroid Dysfunction in Preterm Infants Born at less than 34 weeks Gestation[J].Fetal Pediatr Pathol,2023,42(4):619-629.
[8]ARES SEGURA S,CASANO-SANCHO P,CHUECA GUINDULAIN M,et al.Assessment of thyroid function in the preterm and/or very low birth weight newborn [J].An Pediatr(Engl Ed),2021,95(4):277.e1-277.e8.
[9]CHAPMAN A K,FARMER Z J,MASTRANDREA L D,et al.Neonatal Thyroid Function and Disorders [J].Clin Obstet Gynecol,2019,62(2):373-387.
[10]常莉杰.极低及超低出生体重儿暂时性甲状腺功能减退的风险因素的研究分析[D].合肥:安徽医科大学,2023.
[11]CASTRO G I M,FALC O M C,BIGIO J Z D,et al.Thyroid dysfunction in infants with severe intestinal insufficiency:acaseseries[J].RevPaulPediatr,2023,41:e2021402.
O M C,BIGIO J Z D,et al.Thyroid dysfunction in infants with severe intestinal insufficiency:acaseseries[J].RevPaulPediatr,2023,41:e2021402.
[12]ABBASIR,HARARI-KREMERR,HAIMA,et al.RiskFactors of Congenital Hypothyroidism in Israel[J].Isr Med Assoc J,2022,25(12):808-814.
[13]LARSON C,HERMOS R,DELANEY A,et al.Risk factors associated with delayed thyrotropin elevations in congenital hypothyroidism[J].J Pediatr,2003,143(5):587-591.
[14]藏日娜,李海玲,张雪怡,等.早产儿生后14 天甲状腺功能参考值范围及影响因素[J].中华围产医学杂志,2023,26(3):218-224.
[15]卢晓燕,陈绍红,陈影影,等.34 周以下早产儿促甲状腺激素延迟升高及影响因素[J].临床儿科杂志,2023,41(10):675-679.
[16]ZHU S,XU J,SHI R R,et al.Association between congenital hypothyroidism and in-hospital adverse outcomes in very low birth weight infants [J].Zhonghua Er Ke Za Zhi,2024,62(1):29-35.
[17]陈怡博,余颀,陈志央,等.双胎妊娠生长不一致对新生儿甲状腺功能的影响[J].中华围产医学杂志,2016,19(11):850-854.
[18]RAMEZANI TEHRANI F,NAZARPOUR S.Delivery factors and neonatal thyroid hormone levels:a systematic review[J].J Pediatr Endocrinol Metab,2021,34(7):821-833.
[19]TURUNEN S,VA..A..RA..SMA..KI M,MARTTILA R,et al.Indications for intensive care unit treatment among neonates born to mothers with thyroid disease:A population-based cohort study[J].Acta Obstet Gynecol Scand,2022,101(10):1093-1101.
[20]KOREVAAR T I,CHAKER L,JADDOE V W,et al.Maternal and Birth Characteristics Are Determinants of Offspring Thyroid Function[J].J Clin Endocrinol Metab,2016,101(1):206-213.
[21]陈荣.新生儿生后甲状腺功能检查异常的影响因素分析[J].妇儿健康导刊,2023,2(3):50-52.
[22]赵艳平.新生儿先天性甲状腺功能减退症发生的影响因素[J].中国民康医学,2024,36(3):5-8.
[23]陈新,熊义兴,吴华美.新生儿促甲状腺激素水平的影响因素分析[J].中国卫生标准管理,2022,13(23):10-13.
[24]YUAN X,ZHAO J,WANG J,et al.Pregnancy outcomes and neonatal thyroid function in women with thyroid cancer:a retrospective study [J].BMC Pregnancy Childbirth,2023,23(1):383.
[25]张雪梅,谢邦贵,陈小冰,等.先天性甲状腺功能减低症45 例影响因素分析[J].中国儿童保健杂志,2021,29(11):1233-1236,1268.
[26]KLOSINSKA M,KACZYNSKA A,BEN-SKOWRONEK I.Congenital Hypothyroidism in Preterm Newborns-The Challenges of Diagnostics and Treatment:A Review [J].Front Endocrinol(Lausanne),2022,13:860862.
[27]贺与燕,岑福俊.新生儿先天性甲状腺功能减低症危险因素分析[J].医药前沿,2023,13(2):77-79.
[28]CAMPOS-MARTORELL A,RAMON A M,BARROS K N,et al.Thyroid Function in 509 Premature Newborns Below 31 Weeks of Gestational Age:Evaluation and Follow-up[J].J Clin Res Pediatr Endocrinol,2022,14(4):453-462.