鼻咽癌(nasopharyngeal carcinoma,NPC)是头颈部最常见的恶性肿瘤之一,起源于鼻咽黏膜柱状上皮,病理类型以低分化鳞状细胞癌为主[1]。鼻咽癌在我国南部呈区域性高发特征,是世界其他地区的50~100 倍[2]。放射抗性所致局部治疗失败,导致肿瘤复发或转移,是鼻咽癌治疗失败的主要原因。辐射诱导的基因异常激活和表达是肿瘤放射抵抗的机制之一[3]。细胞因子信号转导抑制蛋白1(suppressors of cytokine signaling 1,SOCS1)作为铁死亡上游调控元件通过引起P53 和胱氨酸/ 谷氨酸逆向转运蛋白(solute carrier family 7,membrane 11,SLC7A11)表达下调诱导铁死亡[4]。铁蛋白重链1(ferritin heavy chain 1,FTH1)是主要的铁储存蛋白的功能亚基,具有铁氧合酶活性,并有效降低Fe2+的毒性[5]。铁死亡驱动因子SOCS1 和抑制因子FTH1 的异常表达及表观遗传学改变已被证明与胃癌、肝癌、非小细胞肺癌和乳腺癌等肿瘤发生、发展相关[6-9]。然而,有关SOCS1 和FTH1 在鼻咽癌中表达水平的研究甚少,且其在鼻咽癌放疗抵抗形成过程中的作用仍不清楚。本研究通过基因表达汇编(gene expression omnibus,GEO)数据库分析SOCS1 和FTH1 在鼻咽癌中的表达及临床意义,并进一步通过细胞实验探索电离辐射照射对鼻咽癌细胞中SOCS1和FTH1 基因表达的影响。
1 材料与方法
1.1 主要材料与仪器
鼻咽癌细胞株C666-1 细胞为广西医科大学王仁生教授惠赠。RPIM-1640 培养基(批号:6123120)和胰蛋白酶(批号:2764709)均购于Gibco 公司;胎牛血清(批号:A122063)购于Gemini Bio 公司;cDNA 逆转试剂盒(批号:Y2012)购于天根生化科技(北京)有限公司;TB Green(批号:AN71060A)购于TaKaRa 公司;引物序列购于生工生物工程(上海)股份有限公司。CO2细胞培养箱(型号:MCO-18AC)购于日本三洋公司;实时荧光定量PCR 仪(型号:CFX Connect)购于百乐科技有限公司;辐照仪(型号:RS-2000)购于Rad Source Technologies 公司。
1.2 数据收集与生物信息学分析
通过GEO 数据库(http://www.ncbi.nlm.nih.gov/geo/)下载具有临床特征数据的鼻咽癌数据集(GSE12452、GSE53819、GSE62328 和GSE48501),GSE12452 和GSE48501 数据来自GPL570 平台(Affymetrix Human Genome U133 Plus 2.0 阵列),前者包含31 份鼻咽癌样本和10 份鼻咽正常组织样本,后者包含放射抵抗性鼻咽癌CNE2-IR 细胞和放射敏感性鼻咽癌CNE2 细胞中mRNA 表达数据。GSE53819 数据来自GPL6480 平台(Agilent-014850 Whole Human Genome Microarray 4x 44K G4112F 阵列),包含18 份鼻咽癌样本和18 份鼻咽正常组织样本。GSE62328 数据来自GPL13693 平台(Phalanx Human OneArray v5 阵列),包含20 份复发性鼻咽癌样本和10 份原发性鼻咽癌样本。利用Perl 语言脚本(v.5.30.0.1)整合具有完整对应临床数据的基因表达矩阵,然后分析在鼻咽癌组织、正常鼻咽组织及不同临床特征间SOCS1 和FTH1 的表达水平。
v5 阵列),包含20 份复发性鼻咽癌样本和10 份原发性鼻咽癌样本。利用Perl 语言脚本(v.5.30.0.1)整合具有完整对应临床数据的基因表达矩阵,然后分析在鼻咽癌组织、正常鼻咽组织及不同临床特征间SOCS1 和FTH1 的表达水平。
1.3 细胞培养与分组
鼻咽癌C666-1 细胞培养于含10%FBS 的RPIM-1640 完全培养基中,37 ℃恒温、5%CO2、潮湿的环境,待细胞密度生长至80%~90%,进行电离辐射照射处理。本课题组前期实验证明,在常规分割(2 Gy)照射结束后48 h,鼻咽癌细胞活力降低[10]。故此次实验中实验组电离辐射照剂量为2 Gy,以电离辐射照射剂量为0 Gy 的鼻咽癌C666-1 细胞为对照组,进一步检测目标基因的表达量。
1.4 实时荧光定量PCR 法检测细胞中SOCS1 和FTH1 mRNA 表达
细胞照射后继续常规培养48 h,收集细胞并使用Trizol 法提取RNA 并逆转录成cDNA,采用2×TB Green qPCR Master MIX 进行RT-qPCR 实验。PCR 反应条件:95 ℃30 s,95 ℃5 s,60 ℃30 s,72 ℃30 s,共40 个循环。以GAPDH 为内参,采用2-ΔΔCt 法计算各基因的表达水平,引物序列见表1。
表1 RT-qPCR 引物序列
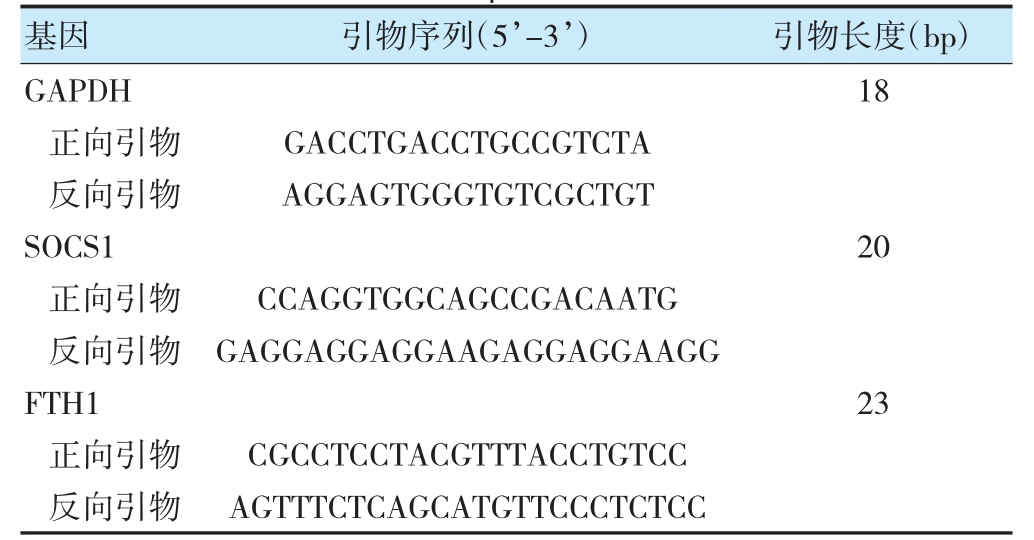
注SOCS1:细胞因子信号转导抑制蛋白1:FTH1:铁蛋白重链1。
1.5 统计学方法
采用R 软件(v.4.2.3)进行生物信息学统计分析,采用Wilcoxon 符号等级检验分析SOCS1 和FTH1 在鼻咽癌组织与正常组织及不同临床特征中的表达水平。采用GraphPad Prism 9 软件对细胞实验数据进行处理及绘图。计量资料采用均数±标准差( )表示。以P<0.05 为差异有统计学意义。
)表示。以P<0.05 为差异有统计学意义。
2 结果
2.1 SOCS1 和FTH1 在鼻咽癌组织、正常组织中的表达水平
GSE53819 数据集结果显示,鼻咽癌组织中SOCS1 和FTH1 表达水平高于正常组织(P<0.001)(图1A~B)。GSE12452 数据集结果显示,鼻咽癌组织中SOCS1 表达水平高于正常组织(P<0.001)(图1C),鼻咽癌组织和正常组织中FTH1 表达水平比较,差异无统计学意义(P>0.05)(图1D)。
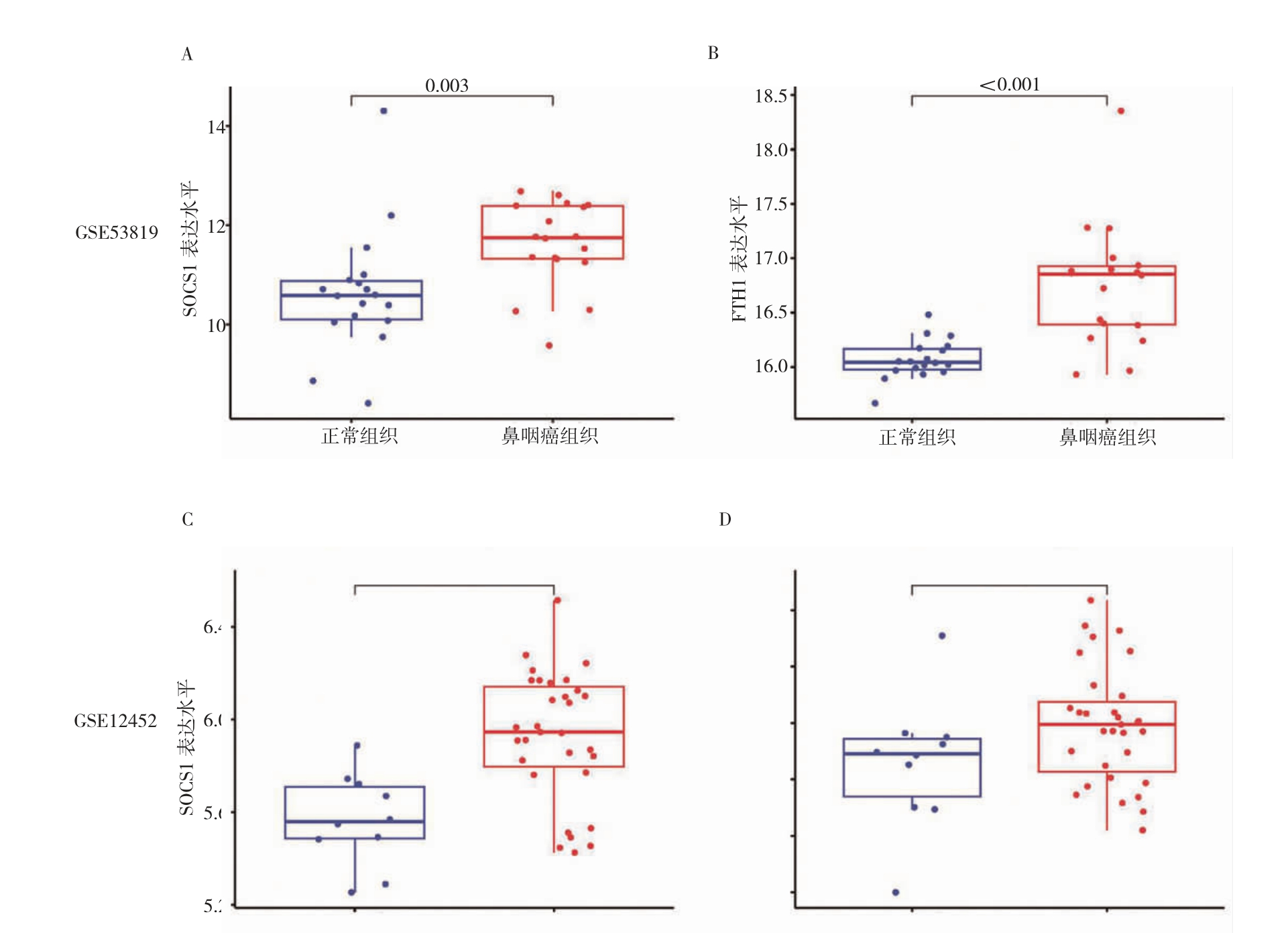
图1 基于GEO 数据库SOCS1 和FTH1 表达分析
A:GSE53819 数据集中SOCS1 表达水平;B:GSE53819 数据集中FTH1 表达水平;C:GSE12452 数据集中SOCS1 表达水平;D:GSE12452 数据集中FTH1 表达水平。SOCS1:细胞因子信号转导抑制蛋白1;FTH1:铁蛋白重链1;GEO:基因表达汇编。
2.2 SOCS1 和FTH1 在不同临床特征表达水平
无淋巴结转移的鼻咽癌样本中SOCS1 和FTH1基因表达水平高于伴淋巴结转移的鼻咽癌样本(P<0.05)(图2A~B)。此外,肿瘤T 分期和原发-复发类型两组样本间SOCS1 和FTH1 表达水平比较,差异无统计学意义(P>0.05)(图2C~F)。
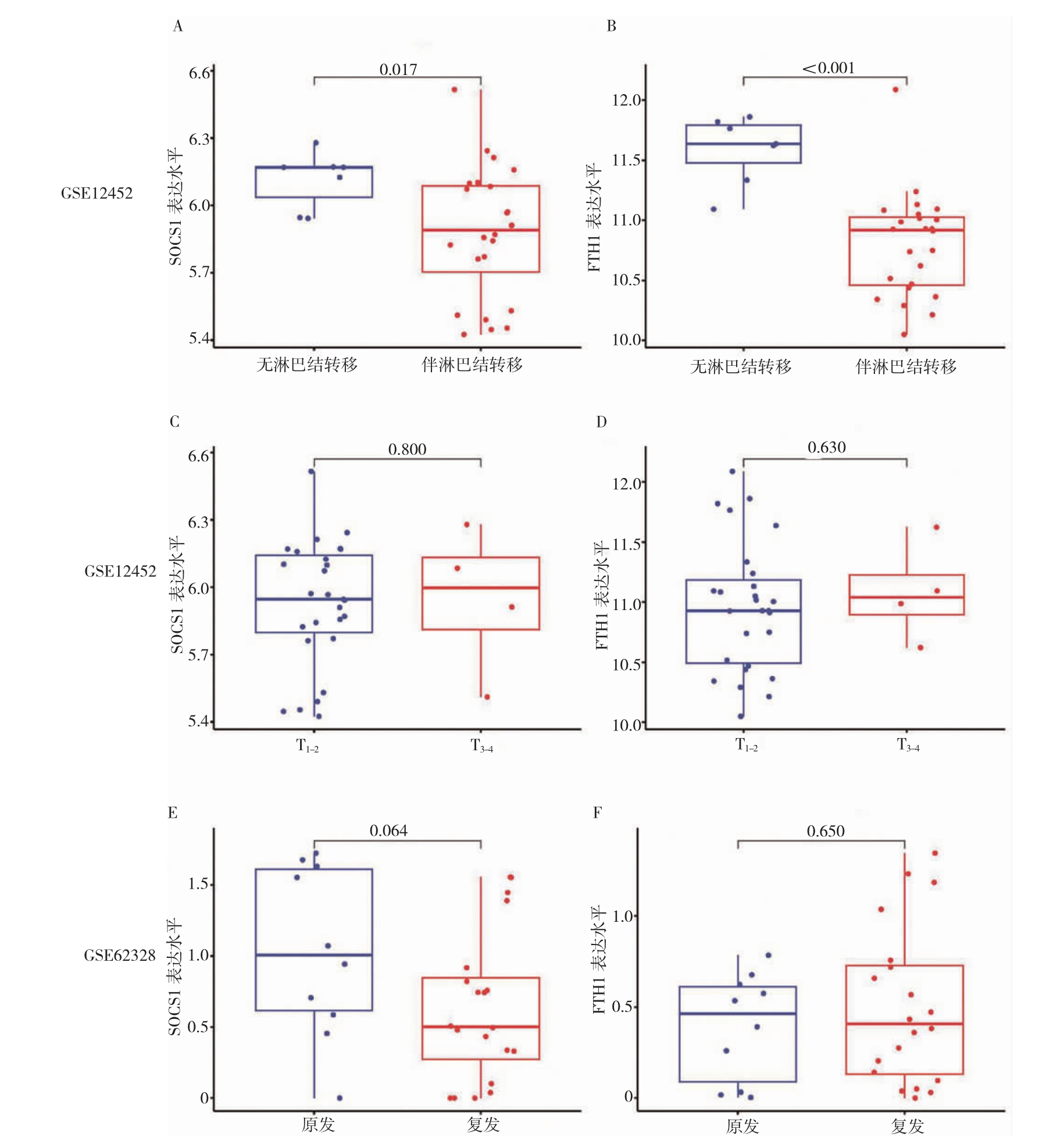
图2 鼻咽癌中SOCS1 和FTH1 基因表达的临床意义
A:GSE12452 数据集中无淋巴结转移或伴淋巴结转移SOCS1 表达水平;B:GSE12452 数据集中无淋巴结转移或伴淋巴结转移FTH1 表达水平;C:GSE12452 数据集中T 分期SOCS1 表达水平;D:GSE12452 数据集中T 分期FTH1 表达水平;E:GSE62328 数据集中原发-复发类型SOCS1 表达水平;F:GSE62328 数据集中原发-复发类型FTH1 表达水平。SOCS1:细胞因子信号转导抑制蛋白1;FTH1:铁蛋白重链1。
2.3 SOCS1 和FTH1 基因表达与鼻咽癌放射敏感性的探索
对含有放射抗性鼻咽癌CNE2-IR 细胞和放射敏感性鼻咽癌CNE2 细胞基因表达数据的GSE48501 数据集分析结果提示,SOCS1 和FTH1 在放射抗性鼻咽癌CNE2-IR 细胞和放射敏感性鼻咽癌CNE2 细胞中表达水平比较,差异无统计学意义(P>0.05)。见图3。
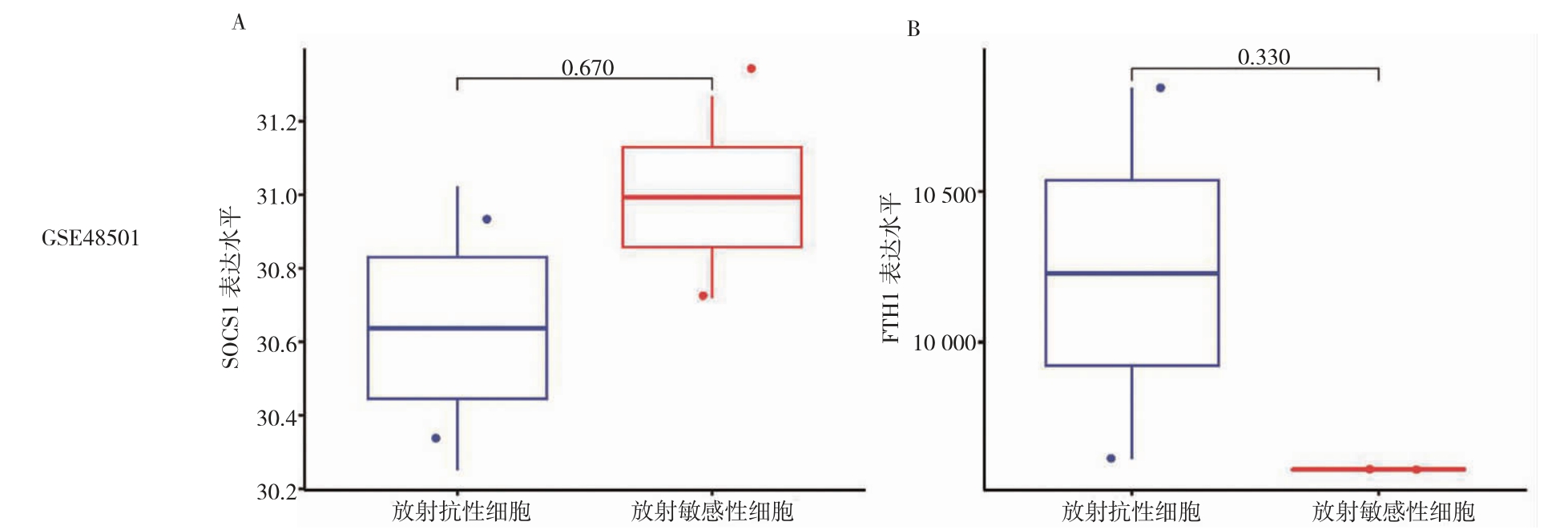
图3 不同放射敏感性鼻咽癌细胞中SOCS1 和FTH1 基因表达
A:SOCS1 在同放射敏感性鼻咽癌细胞中表达水平;B:FTH1 在同放射敏感性鼻咽癌细胞中表达水平。SOCS1:细胞因子信号转导抑制蛋白1;FTH1:铁蛋白重链1。
2.4 电离辐射照射后鼻咽癌细胞中SCOS1 和FTH1的表达
RT-qPCR 结果提示,实验组鼻咽癌C666-1 细胞SCOS1 mRNA 表达水平高于对照组(P<0.05)(图4A)。而实验组鼻咽癌C666-1 细胞中FTH1 mRNA 表达水平低于对照组(P<0.01)(图4B)。

图4 电离辐射照射后鼻咽癌细胞中SCOS1 和FTH1 mRNA 表达水平
A:SOCS1 mRNA 表达水平;B:FTH1 mRNA 表达水平aP<0.05,aaP<0.001。SCOS1:细胞因子信号转导抑制蛋白1;FTH1:铁蛋白重链1。
3 讨论
放射治疗是肿瘤治疗的主要手段之一,有关肿瘤细胞的放射抵抗机制是极其复杂的。从机制上看,放射治疗是利用电离辐射导致包括脂膜在内的细胞间隙的氧化损伤,铁死亡是由有毒脂质过氧化产物的积累引起的,有生物学意义上的相似性,可以推测二者存在一定程度的关联[11-12]。鉴于此,靶向铁死亡可能是提高肿瘤细胞电离辐射敏感性的有效途径。
放射抵抗是鼻咽癌放射治疗中的一个长期挑战。有证据表明,铁死亡在鼻咽癌中发挥抑癌作用,且在越来越多的铁死亡相关生物标志物被发现在鼻咽癌中发挥作用[13]。研究表明,通过铁死亡基因BDH2 降低细胞内铁水平可抑制鼻咽癌细胞的增殖和转移[14]。此外,铁死亡关键因子GSH 水平升高,鼻咽癌组织可表现出一定程度的铁死亡抵抗[15]。最近的研究结果表明,铁死亡抑制因子FANCD2 的表达与鼻咽癌患者的预后有关[16]。
SOCS1 是SOCS 家族一员,作为负反馈调节的一部分,通过抑制酪氨酸激酶信号转导及转录激活因子(JAK/STAT)信号级联来下调细胞因子信号,减弱细胞因子启动的信号转导[17]。而JAK/STAT 通路是肿瘤放射增敏的重要途径。SOCS1 在肿瘤发展中具有双重的作用,其可作为癌基因发挥作用,在黑色素瘤乳腺癌等实体肿瘤中的过度表达[18-19],这与本研究结果一致。此外,SOCS1 也被认为起着肿瘤抑制因子的作用,研究显示SOCS1 在胃癌、肝癌等恶性肿瘤细胞中呈现低表达[7,20]。SOCS1 显示出促进和抑制肿瘤的双重作用,这可能是由于SOCS1 通过不同氨基酸位置的磷酸化来调节其对JAK/STAT 及其与其他癌基因的相互作用[21]。FTH1 具有铁氧化酶活性,在铁死亡过程中,由FTH1 基因编码的铁蛋白参与了Fe3+向Fe2+的转化[22]。研究表明,铁蛋白在多种恶性肿瘤中高表达,且与肿瘤的转移、侵袭、对治疗的抗性及不良预后相关[23]。值得注意的是,有研究表明,血清铁蛋白水平对预测鼻咽癌患者在标准强度调节放疗和化疗后的远处转移有价值[24]。
本研究结果显示,鼻咽癌组织中SCOS1 和FTH1表达水平高于正常鼻咽组织。此外,本研究发现,与伴淋巴结转移的鼻咽癌样本比较,SCOS1 和FTH1 在无淋巴结转移的鼻咽癌样本表达较高,这可能与不同肿瘤阶段中染色体异常、组蛋白修饰、DNA 甲基化等所致mRNA 表达谱改变有关[25]。可能与样本量较小有关,GSE48501 数据集中不同放射敏感性鼻咽癌细胞中SOCS1 和FTH1 基因表达细,差异无统计学意义(P>0.05),需扩大样本量深入研究。为了进一步探索电离辐射对铁死亡驱动因子SOCS1 和铁死亡抑制因子FTH1 的影响,本研究进行了体外实验,结果提示,经2 Gy 电离辐射照射后,鼻咽癌细胞中SCOS1 表达上调、FTH1 表达下调。推测电离辐射可能通过增加SOCS1 的表达或降低FTH1 的表达来诱导鼻咽癌发生铁死亡,起到放疗增敏作用。然而具体的机制尚不明确。
综上所述,铁死亡驱动因子SOCS1 和铁死亡抑制因子FTH1 与鼻咽癌发生、发展密切相关,并且可能是鼻咽癌潜在的放射增敏靶点。本研究为铁死亡在肿瘤放射学中的潜在功能和作用提供了思路。
利益冲突声明:本文所有作者均声明不存在利益冲突。
[1]XIA C,DONG X,Li H,et al.Cancer statistics in China and United States,2022:profiles,trends,and determinants[J].Chin Med J(Engl),2022,135,(5):584-590.
[2]梁冠盈,苗大壮,范宁宁,等.1990—2019 年中国鼻咽癌发病和死亡年龄-时期-队列分析及预测[J].中华肿瘤防治杂志,2024,31(7):391-398,404.
[3]TIAN Y,TANG L,YI P,et al.MiRNAs in Radiotherapy Resistance of Nasopharyngeal Carcinoma [J].J Cancer,2020,11(13):3976-3985.
[4]SAINT-GERMAIN E,MIGNACCA L,VERNIER M,et al.SOCS1 regulates senescence and ferroptosis by modulating the expression of p53 target genes [J].Aging(Albany NY),2017,9(10):2137-2162.
[5]SALATINO A,AVERSA I,BATTAGLIA A M,et al.H-Ferritin Affects Cisplatin-Induced Cytotoxicity in Ovarian Cancer Cells through the Modulation of ROS [J].Oxid Med Cell Longev,2019,2019,3461251.
[6]SHAYIMU P,WANG J B,LIU L,et al.miR-922 regulates apoptosis,migration,and invasion by targeting SOCS1 in gastric cancer[J].2020,36(3):178-185.
[7]LINL,CHENS,WANGH,et al.SPTBN1 inhibitsinflammatory responses and hepatocarcinogenesis via the stabilization of SOCS1 and downregulation of p65 in hepatocellular carcinoma[J].Theranostics,2021,11(9):4232-4250.
[8]BIAMONTE F,BATTAGLIA A M,ZOLEA F,et al.Ferritin heavy subunit enhances apoptosis of non-small cell lung cancer cells through modulation of miR-125b/p53 axis [J].Cell Death Dis,2018,9(12):1174.
[9]LIU N Q,DE MARCHI T,TIMMERMANS A M,et al.Ferritin heavy chain in triple negative breast cancer:a favorable prognostic marker that relates to a cluster of differentiation 8 positive(CD8+)effector T-cell response [J].Mol Cell Proteomics,2014,13(7):1814-1827.
[10]龙金华,冷吉,曾宪琳,等.大分割电离辐射对放射抗性鼻咽癌细胞免疫原性死亡的影响[J].贵州医科大学学报,2023,48(10):1145-1150,1155.
[11]PERILLO B,DI DONATO M,PEZONE A,et al.ROS in cancer therapy:the bright side of the moon[J].Exp Mol Med,2020,52(2):192-203.
[12]ZHOU Q,MENG Y,LI D,et al.Ferroptosis in cancer:From molecular mechanisms to therapeutic strategies[J].Signal Transduct Target Ther,2024,9(1):55.
[13]LI H L,DENG N H,XIAO J X,et al.Cross-link between ferroptosis and nasopharyngeal carcinoma:New approach to radiotherapy sensitization[J].Oncol Lett,2021,22(5):770.
[14]LI B,LIAO Z,MO Y,et al.Inactivation of 3-hydroxybutyrate dehydrogenase type 2 promotes proliferation and metastasis ofnasopharyngealcarcinomabyironretention[J].Br JCancer,2020,122(1):102-110.
[15]XU Y,WANG Q,LI X,et al.Itraconazole attenuates the stemness of nasopharyngeal carcinoma cells via triggering ferroptosis[J].Environ Toxicol,2021,36(2):257-266.
[16]XU S,ZHAO F,LIANG Z,et al.Expression of FANCD2 is associated with prognosis in patien ts with nasopharyngeal carcinoma [J].Int J Clin Exp Pathol,2019,12(9):3465-3473.
[17]SOBAH M L,LIONGUE C,WARD A C.SOCS Proteins in Immunity,Inflammatory D iseases,and Immune-Related Cancer[J].Front Med(Lausanne),2021,8:727987.
[18]QIAN Q,LV Y,LI P.SOCS1 is associated with clinical progression and acts as an oncogenic role in triple-negative breast cancer[J].IUBMB Life,2018,70(4):320-327.
[19]LI Z,CAUVET T,M LLER C,et al.Expression of suppressor ofcytokinesignaling-1inhumanmelanomacells[J].Journal of Investigative Dermatology,2002,119(1):274.
LLER C,et al.Expression of suppressor ofcytokinesignaling-1inhumanmelanomacells[J].Journal of Investigative Dermatology,2002,119(1):274.
[20]刘王静,孙端阳,王兴枝子,等.CRM1 和SOCS1 在胃癌发生发展中作用及与预后的关系[J].右江民族医学院学报,2023,45(2):313-318.
[21]BEAURIVAGE C,CHAMPAGNE A,TOBELAIM W S,et al.SOCS1 in cancer:An oncogene and a tumor suppressor [J].Cytokine,2016,82,87-94.
[22]DI SANZO M,QUARESIMA B,BIAMONTE F,et al.FTH1 Pseudogenes in Cancer and Cell Metabolism [J].2020,9(12):2554.
[23]SHI X,ZHANG A,LU J,et al.An Overview of Heavy Chain Ferritin in Cancer [J].Front Biosci(Landmark Ed),2023,28(8):182.
[24]CHEN X,LONG X,LIANG Z,et al.Higher N stage and serum ferritin,but lower serum albumin levels are associated with distant metastasis and poor survival in patients with nasopharyngeal carcinoma following intensity-modulated radiotherapy[J].Oncotarget,2017,8(42):73177-73186.
[25]HE B,ZHAO Z,CAI Q,et al.miRNA-based biomarkers,therapies,and resistance in Cancer[J].Int J Biol Sci,2020,16(14):2628-2647.