骨髓增生异常综合征(myelodysplastic syndrome,MDS)是一组起源于造血干细胞的异质性髓系克隆性疾病,发病率与年龄呈正相关,其中≥80 岁群体年发病率约为55.4/10 万[1]。MDS 伴原始细胞增多具有向急性髓系白血病(acute myeloid leukemia,AML)转化的高风险、预后差及生存时间短的特点[2]。随着高通量测序技术等分子生物技术的不断发展,目前基因突变被广泛认为是MDS 发病机制和疾病表型的核心,在MDS 治疗和预后判断方面意义重大,其中肿瘤蛋白53(tumor protein p53,TP53)基因突变是MDS 患者预后的独立危险因素,常规治疗反应差,患者生存期短[3-4]。目前伴TP53 基因突变的高龄MDS 患者,受限于自身器官功能下降、合并症多等特点,移植不可行,化疗、去甲基化药物(hypomethylating agents,HMA)治疗耐受性差,生存期短,生活质量低,预后不良。本文回顾1 例含砷中药青黄散方案治疗的超高龄MDS 伴TP53基因突变且伴原始细胞增多Ⅰ型(myelodysplastic syndromes with excessblasts-1,MDS-EB-1)患者的有效病历,分析该方案治疗高龄预后不良MDS 患者的临床效果及安全性,并进行文献复习。
1 病例资料
患者,男,93 岁,主因“发现全血细胞减少6 个月,乏力伴皮肤瘀斑1 周”于2022 年6 月30 日就诊于中国中医科学院西苑医院血液科。患者自诉2021年12月体检发现全血细胞计数减少,白细胞计数(whiteblood cell count,WBC):2.91×109/L,血红蛋白(hemoglobin,Hb):119 g/L,中性粒细胞计数(neutrophilic granulocyte,NEU)、血小板计数(platelet count,PLT)不详,在当地医院检查仅排除常见的贫血,未行特殊治疗,血象三系持续下降。初诊症见:乏力倦怠,皮肤瘀斑,牙龈肿痛,咽部不适,易出汗,口干,食少纳呆,眠差。舌淡暗,苔薄白,脉弦细。查体呈轻度贫血貌,全身皮肤可见少量散在瘀点、瘀斑。血常规示WBC:1.39×109/L,NEU:0.68×109/L,Hb:92 g/L,PLT:46×109/L。2022 年6 月20 日(髂骨)骨髓形态:增生活跃(-),原始占9%,三系可见明显病态造血,符合MDS-EB-1 骨髓象。染色体检查:46,XY,13p+[1]/46,XY[19]。荧光原位杂交检测:未见-5、-7、+8、-Y 的异常信号。既往有高血压病、2型糖尿病、期前收缩、甲状腺功能亢进等病史,血压、血糖控制尚可。中医诊断:髓毒劳(毒瘀阻滞、脾肾亏虚证);西医诊断:MDS-EB-1,修订版国际预后评分系统(revised international prognostic scoring system,IPSS-R)极高危。
中医采用解毒祛瘀、健脾补肾,治疗予含砷中药青黄散方案:青黄散解毒散瘀每日1 粒(0.3 g)饭后服用,补肾健脾方加减每日1 剂联合司坦唑醇每日4 mg,配合支持对症治疗。处方:熟地黄15 g、地黄15 g、山药20 g、酒萸肉10 g、牡丹皮10 g、茯苓15 g、酒女贞子20 g、绵萆薢20 g、盐补骨脂15 g、菟丝子15 g、锁阳20 g、桑椹15 g、太子参30 g、麸炒白术10 g、黄芪30 g、当归6 g、炙淫羊藿10 g、白芍10 g、炙甘草10 g、墨旱莲15 g、醋五味子10 g、炒酸枣仁20 g、北柴胡10 g、生姜10 g、大枣40 g。2022 年8 月9 日二诊:牙龈肿痛减轻,仍有咽部不适,食欲渐复,睡眠改善,夜尿2 次。舌淡暗,苔薄白,脉弦细。前方去酸枣仁,加鸡血藤30 g、防风10 g。2022 年9 月1 日三诊:患者乏力稍减轻,口干、咽部不适缓解,出汗改善,饮食尚可,夜尿1~2次,大便可。舌淡红,苔薄白,脉弦细。前方去五味子。2022 年10 月16 日四诊:乏力、皮肤瘀斑改善,胃纳可。舌淡红,苔薄白,脉弦细。前方将茯苓减量至10 g。2022 年11 月17 日五诊:食后偶有腹胀,余症皆明显减轻,血象稳定。舌淡红,苔薄白,脉弦细。前方去鸡血藤,加黄芩10 g、清半夏6 g。后患者规律门诊复诊,继续含砷中药青黄散方案,随症加减,巩固治疗。治疗初期患者血象三系持续下降需输血维持,每月需输注红细胞2 U。2022 年11 月至2023 年5 月患者脱离输血近半年,Hb 稳定>80 g/L。
2023 年5 月8 日患者因乏力加重住院,血常规示WBC:1.04×109/L,NEU:0.25×109/L,Hb:68 g/L,PLT:48×109/L。复查骨髓穿刺等检查。2023 年5 月15 日(髂骨)骨髓形态:增生活跃(-),原始占1.5%,粒系、红系可见明显病态造血,符合MDS-EB-1 治疗后骨髓象。白血病免疫分型:CD34+CD17+细胞为3.1%,提示为原始髓细胞。染色体检查:der(13)t(13,15)(q10,q10)[1]/46,XY[19]。二代基因测序:TP53(p.V272M):41.05%,BCOR(p.I6510fs):82.62%,STAG2(p.K917):85.08%,U2AF1(p.S34F):41.79%,CSF3R(p.P733T):48.88%。根据分子国际预后评分系统(molecular internationalprognosticscoringsystem,IPSS-M)评分3.03分,提示极高危。患者2023 年5 月感染新型冠状病毒,经治疗好转后合并细菌及真菌感染,出现输血依赖。2023 年6 月20 日复诊症见:乏力倦怠,皮肤瘙痒,纳眠可,二便调。查体可见皮肤散在少量瘀斑。舌淡暗,苔薄白,脉弦细略数。继续维持含砷中药青黄散方案,处方以第3 次复诊方中去淫羊藿、锁阳,加蒲公英20 g,配合间断输注红细胞支持及抗感染等对症治疗,平均每月需输注红细胞2 U。后患者规律门诊复诊,症状逐渐改善,继续维持含砷中药青黄散方案治疗8 个月后(2024 年2 月21 日)患者病情平稳,用药期间未出现治疗相关不良事件,心、肝、肾功能未见明显异常。参照MDS 国际工作组修订的疗效标准,治疗初期每月需输注红细胞2 U,治疗5个月左右于2022 年11 月4 日最早出现红系反应,2022 年11 月至2023 年5 月在未输血的情况下Hb 稳定>80 g/L,后因感染等呈输血依赖,从2023 年5月8 日开始输血,5 个月共输注红细胞4 U,其后每月红细胞输注量1~4 U,平均每月需输注红细胞2 U[5]。在2023 年9、10 月分别获得血小板反应和中性粒细胞反应。骨髓涂片提示原始细胞较前减少,未出现疾病进展。患者外周血中Hb、红细胞输注量的变化趋势见图1,白细胞、中性粒细胞、血小板变化趋势见图2。门诊随诊至今,2024 年2 月21 日血常规显示,WBC:2.19×109/L,NEU:0.93×109/L,Hb:80 g/L,PLT:62×109/L。本研究经中国中医科学院西苑医院医学伦理委员会审核批准(2022XLA 109-2)。
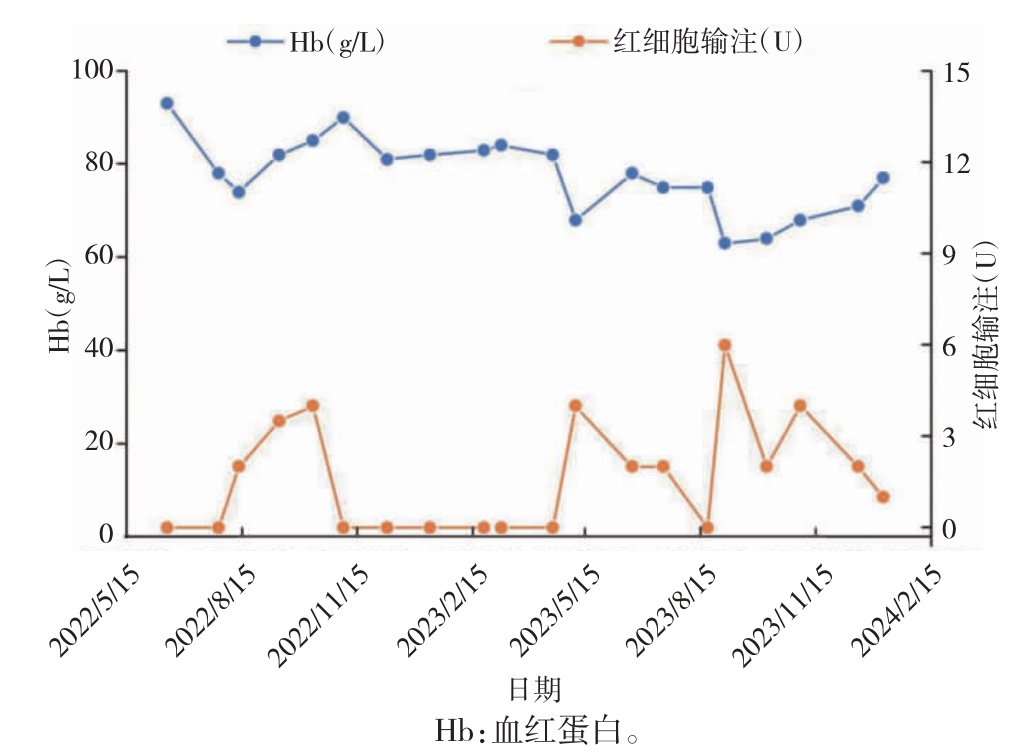
图1 治疗期间Hb、红细胞输注趋势
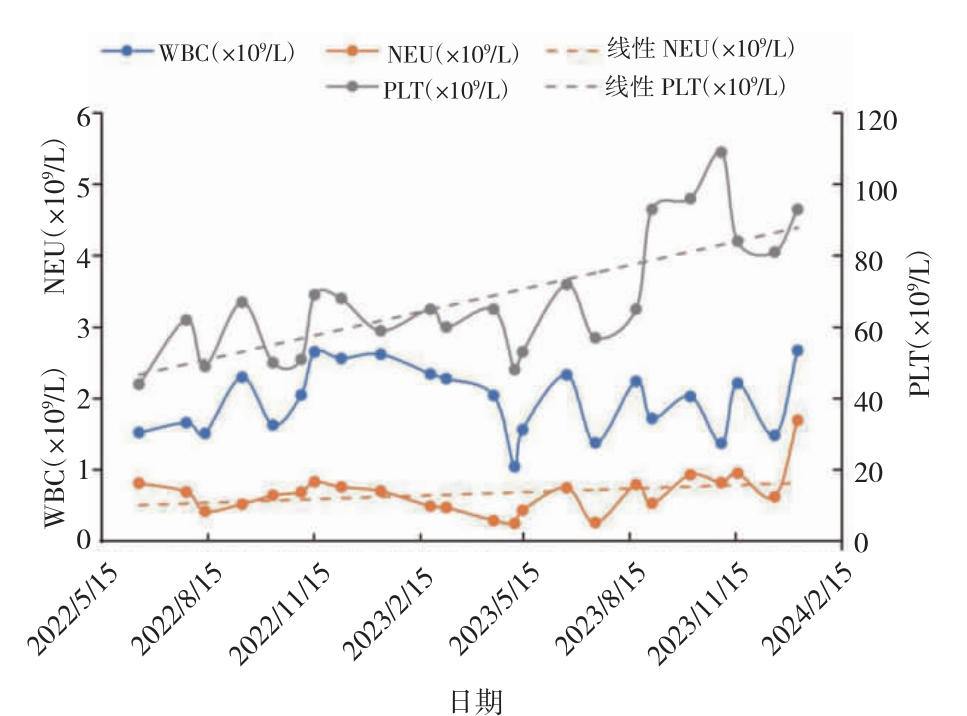
图2 治疗期间WBC、NEU 和PLT 变化趋势
WBC:白细胞计数;NEU:中性粒细胞计数;PLT:血小板计数。
2 讨论
高龄较高危MDS 的伴原始细胞增多亚型比例高,基因突变检出率高,且TP53 基因突变明显增多[6-8]。TP53 基因是一种抑癌基因,其编码的p53 蛋白通过DNA 损伤修复、细胞周期调控、诱导凋亡等多种途径发挥重要的肿瘤抑制作用[9]。TP53 基因突变在较高危MDS 患者中的发生率为25%,是预后的独立危险因素[3,10]。Haase 等[3]研究表明,伴TP53 基因突变的患者与外周血Hb 水平和PLT 较低、骨髓原始细胞比例较高的临床表型相关。本例患者就诊时外周血全血细胞呈进行性下降,骨髓原始细胞9%,治疗初期每月需输注红细胞约2 U,与文献报道相符。
高龄、高预后评分、基因突变使患者预后不良,结合患者一般基础疾病较多、器官功能减退及总体体能评分差,故治疗方法局限,以对症支持治疗为主,导致生活质量降低,生存期短。目前,异基因造血干细胞移植是治愈MDS 的唯一方法,AML 样化疗、HMA 治疗是较高危MDS 患者的主要治疗方案,但受限于患者自身器官功能下降、合并症多等原因,高龄MDS 患者异基因造血干细胞移植不可行,AML 样化疗、HMA 治疗后易出现骨髓抑制期延长,耐受性差。TP53 基因突变是影响移植后生存的独立危险因素,移植后复发率高,中位生存期约8 个月[11]。由于细胞毒性化疗药物高度依赖完整p53 蛋白而发挥治疗作用,TP53 基因突变导致其对化疗的耐药性[12]。有研究表明,TP53 基因突变可提高HMA 治疗的应答率,但反应持续时间短暂,多数患者在完全缓解后6 个月内复发[13]。也有研究认为,TP53 基因突变对应答率并无显著影响[14]。一项HMA 治疗的TP53 基因突变AML/高危MDS 随机临床试验显示TP53 基因突变患者的不良预后,且AML 和MDS 患者的结局相似,中位总生存期与单打击和多打击TP53 基因突变状态无关(7.6 个月vs.10.6 个月)[15]。一些新药(如B 淋巴细胞瘤-2 抑制剂、整联蛋白相关蛋白单克隆抗体、T 淋巴细胞免疫球蛋白黏蛋白-3 单克隆抗体)联合HMA 的早期临床试验证明对TP53 基因突变的较高危MDS 有疗效[16];但遗憾的是更大样本量、更长随访或随机试验的更新结果均未达到预期效果[17]。
中医古籍文献无MDS 的明确记载,直至2008 年现代中医血液病专家根据MDS 的病位、病性、病机与病状,将其中医病名定为“髓毒劳”[18]。“髓”代表病位在骨髓,“毒”代表病性为瘀毒,“劳”代表病情。《景岳全书》载“凡脾肾不足及虚弱失调之人,多有积聚之病”。素体正气虚损,复感邪毒,因毒致瘀,毒瘀互结。瘀血阻滞则新血不生,瘀阻脉络则血不循经,故可出现出血和贫血等症状。病机属邪实正虚证,毒瘀为本,气血阴阳虚损为标。病位以脾、肾为主。中医临床多根据其辨证分型,病证结合进行治疗。
本例患者西医诊断明确为MDS-EB-1(IPSS-R极高危、IPSS-M 极高危)。伴有TP53(41.05%)、BCOR(82.62%)、STAG2(85.08%)、U2AF1(41.79%)、CSF3R(48.88%)基因突变,其中TP53、U2AF1 突变为MDS不良预后因素。研究表明MDS 患者基因突变的数量与无病生存期呈负相关,与向白血病转化的风险呈正相关[19]。中医辨病属髓毒劳,辨证为毒瘀阻滞、脾肾亏虚。本例患者发病时年龄91 岁,属于超高龄患者,治疗以驱邪扶正为主,针对毒瘀互结、正虚邪实之病机,以解毒祛瘀、健脾补肾为法,予青黄散方案联用司坦唑醇,青黄散为主,解毒散瘀,以“去其所害”;补肾健脾汤药为辅,补脾肾而益生化之源,使“气血复生”,联用司坦唑醇以促进造血。
青黄散始载于《奇效良方》,方中青黛咸寒,消肿散瘀、凉血解毒;雄黄辛温,解百毒、消积聚、化瘀血,两药合用祛邪解毒、活血化瘀[20]。既往回顾性临床研究表明,青黄散为主复方治疗伴原始细胞增多型MDS,6 个月后总有效率达69.4%[21]。前期实验发现青黄散中的靛玉红和二硫化二砷单药均可通过调控凋亡相关蛋白B 淋巴细胞瘤-2、B 淋巴细胞瘤-2 相关X 蛋白、半胱氨酸蛋白酶-3 表达,从而抑制MDS 细胞株增殖,发挥调控细胞周期、促进细胞凋亡作用,两者联合用药作用更明显,且可能通过上调GATA 结合蛋白1、GATA 结合蛋白2、GATA 结合蛋白3 促进红系分化改善贫血[22-24]。随着表观遗传学的不断进展,研究发现DNA 甲基化异常与MDS 的发生和发展存在密切关联,青黄散为主复方能通过调控核抑癌基因的高甲基化水平,发挥对肿瘤细胞的抑制增殖和促凋亡作用[24]。研究发现砷原子可填补导致p53 突变蛋白结构不稳定的空腔并提高其结构稳定性,使p53 蛋白发生结构性突变后仍然保持三级结构及抑癌功能,且恢复p53 蛋白折叠能力的量化数据显示,在若干数量级上优于已报道的p53 蛋白功能恢复化合物[25-26]。本例患者治疗期间,随着Hb 水平上升,外周血有核红细胞、网织红细胞升高,结合相关检查排除溶血、骨髓纤维化等疾病,考虑与砷剂促进红系分化成熟有关。本例患者TP53 基因突变位点为p.V272M,突变频率为41.05%,经含砷中药青黄散方案治疗有效,其取效机制有待进一步研究。
补肾健脾方由六味地黄汤和四君子汤加减化裁而成,旨在健脾补肾、填精益髓生血。《张氏通医》“人之虚,非气即血,五脏六腑莫能外焉,而血之源头在乎肾,气之源头在乎脾”。基于阴阳互根理论,即“善补阴者,必于阳中求阴,则阴得阳升而泉源不竭”,根据症状舌脉变化判定阴阳寒热的盛衰调整滋阴药与温阳药的比重。研究表明补肾健脾中药可提高骨髓的造血功能,联用司坦唑醇共同改善MDS 骨髓衰竭所导致的血细胞减少[27]。
该患者年逾九十,邪毒瘀滞于阴分,由内而发为肌衄,症见皮肤少量散在瘀斑;脾肾脏腑功能衰退,气血阴阳俱虚,症见乏力倦怠,食少纳呆,神失所养,则见眠差,津液耗散不固,则见易汗出,夜尿频;肾阴不足,水不济火,津液亏虚不能上承于咽喉,症见口干,咽部不适,牙龈肿痛;瘀毒阻滞,正气亏虚,故见舌淡暗,脉弦细。治疗强调以解毒祛瘀、健脾补肾为主。具体而言,青黄散方案中君药以青黛、雄黄解毒散瘀,以祛其邪毒;臣药以生地黄、熟地黄、菟丝子等补肾填精益髓,太子参、白术、山药等健脾益气扶正,以使先后天相互资生,气血生化有源;佐药以黄芪、当归等益气养血活血,以培补其损;使药以甘草、生姜、大枣益胃和中、缓和药性。诸药合用,共奏解毒祛瘀、补肾健脾之功。肾阴不足为主,加桑椹、墨旱莲滋补肾阴兼凉血止血,炙淫羊藿以阳中求阴;易汗出、夜尿频,遵循《素问·至真要大论篇》“散者收之”的治疗法则,加醋五味子以益肾健脾、敛汗缩尿;眠差,加酸枣仁、白芍养血敛阴、宁心安神。二诊:睡眠改善,仍有咽部不适,舌淡暗等血瘀之象,去酸枣仁,加鸡血藤、防风养血活血。三诊:易汗出、夜尿频改善,减五味子之酸收。四诊:胃气渐复,茯苓减量以防伤阴。五诊:瘀滞之象好转,食后偶有腹胀,去鸡血藤,加黄芩、半夏,取半夏泻心汤之义,以辛开苦降,恢复中焦气机升降。2023 年6 月20 日复诊患者肾阴不足加温热病瘥,致伤阴更甚,阴虚化燥,虚火灼络,而见皮肤瘙痒、皮肤瘀斑、舌淡暗、脉弦细略数等症,去锁阳、淫羊藿,恐补阳助火动血,于滋阴基础上加蒲公英以清降虚火而不损中土。
本例患者为伴TP53 基因突变的超高龄MDS-EB-1(IPSS-R 极高危、IPSS-M 极高危),文献报道的预计中位总生存期约1 年[28]。立足于毒瘀阻滞、脾肾亏虚的基础病机,应用含砷中药青黄散方案治疗,随症加减,随访至2024 年2 月21 日,发病26 个月,与文献报道的同类型患者比较,生存期延长,中性粒细胞及血小板计数上升后保持稳定,治疗初期脱离红细胞输注时间约半年,治疗1 年后因反复感染需间断输血,不适症状改善,生活质量提高。治疗过程中未发生治疗相关不良反应,耐受性良好。达到老年MDS 患者提高生活质量、延长生存期的治疗目标。提示含砷中药青黄散方案治疗伴TP53 基因突变的超高龄MDS-EB-1 有一定效果且安全,以期为后续高龄伴TP53 基因突变高危MDS 患者的中西医结合治疗提供借鉴,值得临床扩大样本量进一步研究。
利益冲突声明:本文所有作者均声明不存在利益冲突。
[1]GREENBERG P L,STONE R M,AL-KALI A,et al.NCCN guidelines(R)insights:myelodysplastic syndromes,version 3.2022[J].J Natl Compr Canc Netw,2022,20(2):106-117.
[2]许鸣,陆嘉惠.骨髓增生异常综合征发病机制研究进展[J].中国实验血液学杂志,2015,23(6):1800-1807.
[3]HAASE D,STEVENSON K E,NEUBERG D,et al.TP53 mutation status divides myelodysplastic syndromes with complex karyotypes into distinct prognostic subgroups [J].Leukemia,2019,33(7):1747-1758.
[4]JIANG L,LUO Y,ZHU S,et al.Mutation status and burden can improve prognostic prediction of patients with lower-risk myelodysplasticsyndromes[J].Cancer Sci,2020,111(2):580-591.
[5]CHESONBD,GREENBERGPL,BENNETTJM,et al.Clinical application and proposal for modification of the International Working Group(IWG)response criteria in myelodysplasia[J].Blood,2006,108(2):419-425.
[6]张彤彤,孙爱宁,潘金兰,等.单中心550 例骨髓增生异常综合征患者临床特点、细胞遗传学特征及预后分析[J].中华血液学杂志,2016,37(10):864-869.
[7]LI B,LIU J,JIA Y,et al.Clinical features and biological implications of different U2AF1 mutation types in myelodysplastic syndromes[J].Genes Chromosomes Cancer,2018,57(2):80-88.
[8]赵文舒,范志平,黄芬,等.老年中高危骨髓增生异常综合征患者的临床特点及预后研究[J].中国实验血液学杂志,2021,29(3):840-846.
[9]GANGULY B B,KADAM N N.Mutations of myelodysplastic syndromes(MDS):an update[J].Mutat Res Rev Mutat Res,2016,769:47-62.
[10]KULASEKARARAJ A G,SMITH A E,MIAN S A,et al.TP53 mutations in myelodysplastic syndrome are strongly correlated with aberrations of chromosome 5,and correlate with adverseprognosis[J].Br J Haematol,2013,160(5):660-672.
[11]LINDSLEY R C,SABER W,MAR B G,et al.Prognostic mutations in myelodysplastic syndrome after stem-cell transplantation[J].N Engl J Med,2017,376(6):536-547.
[12]JOERGER A C,FERSHT A R.The tumor suppressor p53:from structures to drug discovery[J].Cold Spring Harb Perspect Biol,2010,2(6):a000919.
[13]WELCH J S,PETTI A A,MILLER C A,et al.TP53 and decitabine in acute myeloid leukemia and myelodysplastic syndromes[J].N Engl J Med,2016,375(21):2023-2036.
[14]FALCONI G,FABIANI E,PICIOCCHI A,et al.Somatic mutations as markers of outcome after azacitidine and allogeneic stem cell transplantation in higher-risk myelodysplastic syndromes[J].Leukemia,2019,33(3):785-790.
[15]ZEIDAN A M,BEWERSDORF J P,HASLE V,et al.Prognostic implications of mono-hit and multi-hit TP53 alterations in patients with acute myeloid leukemia and higher risk myelodysplastic syndromes treated with azacitidine-based therapy[J].Leukemia,2023,37(1):240-243.
[16]SALLMAN D A,AL MALKI M M,ASCH A S,et al.Magrolimab in combination with azacitidine in patients with higher-risk myelodysplastic syndromes:final results of a phase Ⅰb study[J].J Clin Oncol,2023,41(15):2815-2826.
[17]ZEIDAN A M,GIAGOUNIDIS A,SEKERES M A,et al.STIMULUS-MDS2 design and rationale:a phase Ⅲtrial with the anti-TIM-3 sabatolimab(MBG453)+azacitidine in higher risk MDS and CMML-2[J].Future Oncol,2023,19(9):631-642.
[18]陈信义,麻柔,李冬云.规范常见血液病中医病名建议[J].中国中西医结合杂志,2009,29(11):1040-1041.
[19]PAPAEMMANUIL E,GERSTUNG M,MALCOVATI L,et al.Clinical and biological implications of driver mutations in myelodysplastic syndromes [J].Blood,2013,122(22):3616-3627,3699.
[20]李柳,麻柔.含砷古方青黄散治疗恶性血液系统疾病[J].医学研究杂志,2019,48(12):1-3.
[21]王德秀,麻柔,李柳,等.青黄散联合补肾健脾方及雄激素治疗伴原始细胞增多骨髓增生异常综合征疗效回顾性分析[J].中国中西医结合杂志,2019,39(1):33-37.
[22]杨秀鹏,周庆兵,麻柔,等.二硫化二砷和靛玉红对骨髓增生异常综合征细胞MUTZ-1 凋亡及其相关蛋白的影响[J].疑难病杂志,2017,16(11):1132-1136.
[23]吴建伟,黄建栩,郑荣,等.青黄散组分抑制BCL-2、XIAP-1、c-IAP 协同诱导KG1a 细胞凋亡的实验研究[J].中国当代医药,2018,25(18):10-16.
[24]ZHOU Q B,YANG X H,WANG H Z,et al.Effect of qinghuang powder combined with bupi yishen decoction in treating patients with refractory cytopenia with multilineage dysplasia through regulating DNA methylation [J].Chin J Integr Med,2019,25(5):354-359.
[25]CHEN S,WU J L,LIANG Y,et al.Arsenic trioxide rescues structural p53 mutations through a cryptic allosteric site[J].Cancer Cell,2021,39(2):225.e228-239.e228.
[26]SONG H,WU J,TANG Y,et al.Diverse rescue potencies of p53 mutations to ATO are predetermined by intrinsic mutational properties [J].Sci Transl Med,2023,15(690):eabn9155.
[27]刘驰,张姗姗,肖海燕,等.补肾健脾方配合促红细胞生成素治疗低中危骨髓增生异常综合征43 例[J].陕西中医,2011,32(9):1147-1148.
[28]BERNARD E,TUECHLER H,GREENBERG P L,et al.Molecular international prognostic scoring system for myelodysplastic syndromes[J].NEJM Evid,2022,1(7):EVIDoa2200008.